
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
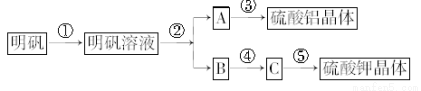
(1)进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是________________________,其反应的离子方程式为 。
(2)进行操作④时,所加入的试剂是___________,其目的是_______________,同时要对反应混合物进行的操作是________________。
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
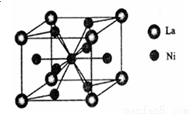
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
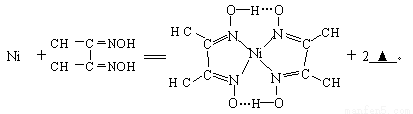
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O 2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
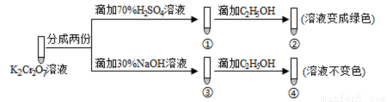
结合实验,下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
D.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
有100 mL 3.5 mol·L-1的NaOH溶液和100 mL 1 mol/L的AlCl3溶液,按如下两种方法进行实验:
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌)。
比较两次实验的结果,其中正确的是( )
A.现象相同,沉淀量相等 B.现象不同,沉淀量不等
C.现象相同,沉淀量不等 D.现象不同,沉淀量相等
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁铝合金5.1 g溶于300 mL 2 mol·L-1的盐酸中,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:填空题
工业上常用FeCl3溶液制印刷电路板并再生,主要过程如下:
腐蚀Cu:2FeCl3+Cu=CuCl2+2FeC12;
然后回收Cu:Fe+CuCl2=Cu+FeCl2;
再生FeC13:2FeC12+C12=2FeC13。
将某电路板上的Cu腐蚀完全,恰好消耗0.5L2mol/LFeCl3。全过程忽略体积的变化。
回答下列问题:
(1)画出Cl原子结构示意图:________________;
(2)将Cu腐蚀一半时,溶液中的金属阳离子有:_______________;此时c(Cl-)为:____________mol/L;
(3)腐蚀的Cu的总物质的量为:______________mol;
(4)再生FeC13时,溶液由___________色最终变为___________色;消耗的Cl2在标准状况下的体积至少为:________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com