
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
|
| A. | 0.04mol/L | B. | 0.2mol/L | C. | 1mol/L | D. | 2m01/L |
科目:高中化学 来源: 题型:
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度 /℃ | 初始CCl4的浓度 /(mol • L﹣1) | 初始H2的浓度/(mol • L﹣1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为___________,在110℃时平衡常数为_____________。
②实验1中,CCl4的转化率A____________50%(填”大于”“小于”或”等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值____________(填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料无法判断
(2)120℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol • L﹣1和4 mol • L﹣1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。
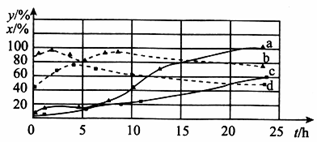
①在图中的四条线中,表示H2的起始浓度为2mol • L﹣1的实验消耗CCl4的百分率变化曲线是___________(填序号)。
②根据上图曲线,氢气的起始浓度为___________mol • L﹣1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
|
| A. | K2CO3和K2O都属于盐 |
|
| B. | Na2O和Na2SiO3都属于氧化物 |
|
| C. | KOH和Na2CO3都属于碱 |
|
| D. | H2SO4和HNO3都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
炒菜时,加一点酒(主要成分乙醇)和醋(主要成分乙酸)能使菜味香可口,原因是( )
|
| A. | 有碱类物质生成 | B. | 有酸类物质生成 |
|
| C. | 有醇类物质生成 | D. | 有酯类物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
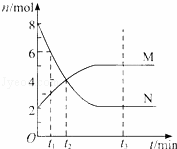
|
| A. | 反应的化学方程式为:2M⇌N |
|
| B. | t2时,正逆反应速率相等,达到平衡 |
|
| C. | t3时,正反应速率大于逆反应速率 |
|
| D. | t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述中,正确的是( )
|
| A. | 电子层序数越大,s原子轨道的形状相同、半径越小 |
|
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 |
|
| C. | 镁原子由1s22s22p63s2→ls22s22p63p2时,原子吸收能量,由基态转化成激发态 |
|
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com