
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
分析 晶体中2个最近的Cs+核间距为acm,相邻顶点上Cs+核间距离最近,为acm,即晶胞的棱长为acm,体积V=a3cm3,该晶胞中Cs+个数=8×$\frac{1}{8}$=1,Cl-个数为1,根据晶胞密度公式ρ=$\frac{m}{V}$计算氯化铯密度.
解答 解:氯离子位于顶点,晶胞中数目为8×$\frac{1}{8}$=1,铯离子位于体心,数目为1,即一个晶胞中含有一个氯离子和一个铯离子,则一个晶胞质量为 $\frac{M}{N{\;}_{A}}$g,2个最近的Cs+离子核间距为acm,即晶胞边长为acm,则晶胞体积为a3cm3,则密度为 $\frac{M}{{N}_{A}•{a}^{3}}$g•cm-3,
故选C.
点评 本题考查晶胞密度计算,难度不大,应准确计算出晶胞所含微粒数目.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:多选题
| A. | 同族元素,随着电子层的增加,I1逐渐增大 | |
| B. | 通常情况下,电离能I1<I2<I3 | |
| C. | 同周期元素,随着核电荷数的增加,I1呈增大趋势 | |
| D. | 电离能越小,元素的金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
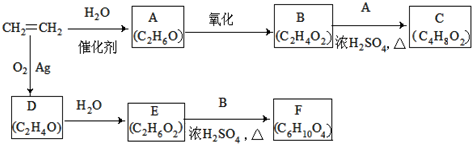
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
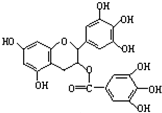 绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )
绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )| A. | EGCG易被氧化 | |
| B. | EGCG的分子中有1个手性碳原子 | |
| C. | 1mol EGCG与浓溴水发生取代反应时最多消耗6molBr2 | |
| D. | 1mol EGCG与氢氧化钠溶液反应最多消耗10molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成2mol SO2的同时,消耗2molSO3 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1molSO2 | |
| D. | 混合气体的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com