
| 化学键 | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-l | 413 | 436 | 343 | 465 |
分析 (1)能够从自然界源源得到补充的能源是可再生能源,例如水能、风能、太阳能等;
(2)①由热化学方程式可知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-l,4g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为483.6kJ,则l g放出的热量为$\frac{483.6kJ}{4}$=120.9kJ,而氢气被称为绿色能源的主要原因是燃烧产物是水且无污染;
②若18g C(s)的物质的量是$\frac{18g}{12g/mol}$=1.5mol,氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,所以一氧化碳的物质的量为:
1.5mol×$\frac{2}{3}$=1mol,CO2(g)的物质的量为0.5mol,根据盖斯定律分析求解;
③Ⅰ2C(s)+O2(g)═2CO(g);△H=-221.0KJ/mol
Ⅱ2H2(g)+O2(g)═2H2O;△H=-483.6KJ/mol
依据盖斯定律,$\frac{Ⅰ-Ⅱ}{2}$得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol;
(3)依据化学反应焓变=反应物键能总和-生成物键能总和计算.
解答 解:(1)煤、石油、天然气以及核能短期内从自然界得不到补充,属于不可再生能源,而太阳能、氢能可以从自然界源源不断的得到补充,属于可再生能源,
故选A.
(2)①由热化学方程式可知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-l,4g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为483.6kJ,则l g放出的热量为$\frac{483.6kJ}{4}$=120.9kJ,而氢气被称为绿色能源的主要原因是燃烧产物是水且无污染,故答案为:120.9;燃烧产物是水,无污染;
②根据盖斯定律,Ⅰ、2C(s)+O2(g)=2COg)△H=-221.0kJ•mol-l
Ⅱ、2CO(g)+O2(g)=2CO2(g)△H=-556.0kJ•mol-l
由Ⅰ+Ⅱ可得:C(s)+O2(g)=CO2(g)△H=-388.5kJ•mol-l
18g C(s)的物质的量是$\frac{18g}{12g/mol}$=1.5mol,氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,所以一氧化碳的物质的量为:
1.5mol×$\frac{2}{3}$=1mol,CO2(g)的物质的量为0.5mol,所以388.5-110.5=278kJ,故答案为:278kJ;
③Ⅰ2C(s)+O2(g)═2CO(g);△H=-221.0KJ/mol
Ⅱ2H2(g)+O2(g)═2H2O;△H=-483.6KJ/mol
依据盖斯定律,$\frac{Ⅰ-Ⅱ}{2}$得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol,故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol;
(3)设C≡O键的键能为x,则CO(g)+2H2(g)?CH3OH (g),反应的焓变=反应物总键能之和-生成物总键能之和,故△H=x+2×436KJ/mol-(3×413KJ/mol+343KJ/mol+465KJ/mol)=-99 kJ•mol-1,所以x=1076,故答案为:1076.
点评 本题考查热化学方程式和运用盖斯定律计算,题目较简单,注意把握盖斯定律的原理,侧重于计算能力的考查.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 化学品 | 浓硫酸 | Na2O2 | Na | 硫 |
| 危险警告标志 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
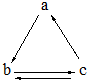 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | CO2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳铵与碱性肥料混合施用.以提高肥效 | |
| B. | 用氧化铝制造耐火材料 | |
| C. | 在医疗上,可用碳酸氢钠治疗胃酸过多 | |
| D. | 用硫酸钡制作白色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
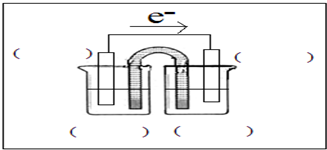 能量之间可以相互转化:原电池可将化学能转化为电能.
能量之间可以相互转化:原电池可将化学能转化为电能.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com