
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
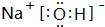 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;分析 由元素在周期表中的位置可知,A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ar、J为Si,
(1)稀有气体化学性质最不活泼;F元素只有负化合价,没有正化合价;可用于制半导体材料的元素是硅;
(2)Na的金属性最强,故NaOH碱性最强,氢氧化钠为离子化合物,阴阳离子需要标出所带电荷,氢氧根离子需要标出最外层电子;酸性最强的为高氯酸;氢氧化铝是两性氢氧化物;
(3)非金属性越强,氢化物越稳定;
(4)电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小.
解答 解:由元素在周期表中的位置可知,A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ar、J为Si,
(1)稀有气体Ar的化学性质最不活泼;F元素只有负化合价,没有正化合价;可用于制半导体材料的元素是硅,
故答案为:Ar;F;Si;
(2)Na的金属性最强,故NaOH碱性最强,其电子式为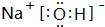 ;酸性最强的为高氯酸;氢氧化铝是两性氢氧化物,
;酸性最强的为高氯酸;氢氧化铝是两性氢氧化物,
故答案为:NaOH;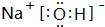 ;HClO4;Al(OH)3;
;HClO4;Al(OH)3;
(3)F元素的非金属性最强,故HF最稳定,
故答案为:HF;
(4)B、C、D、J、E、F、G、H中,电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径最大的为Na,
故答案为:Na.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,明确元素周期表结构 为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | 云、烟、雾等均能产生丁达尔现象 | |
| B. | PM2.5分散在大气中一般构不成胶体 | |
| C. | “雾霾”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用脱硫处理的煤代替原煤做燃料可以有效减少空气中CO2气体的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 命名 | 一氯代物 | |
| A | 2-甲基-2-乙基丙烷 | 3 |
| B | 1,3-二甲基苯 | 3 |
| C | 2,2,3-三甲基戊烷 | 6 |
| D | 2,3-二甲基-4-乙基己烷 | 7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.
.从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为N>O>B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2反应 | B. | 铝片与稀H2SO4反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成两条共价键 | |
| B. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 晶体熔化时化学键不一定发生断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com