
 ,Na2O2的电子式
,Na2O2的电子式
分析 (1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;Na2O2 是离子化合物,2个钠离子与1个过氧根离子构成,过氧根离子内部存在O-O共价键;
(2)白色沉淀转化为淡黄色沉淀,发生沉淀的转化,AgCl转化为AgBr;
(3)反应中Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律配平书写方程式;
(4)AlCl3和NaOH反应与NaOH的量的多少有关,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.现AlCl3的物质的量为0.03mol,完全生成Al(OH)3沉淀时,沉淀质量应为2.34g,现沉淀质量为0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
解答 解:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为:
,Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为: ;故答案为:
;故答案为: ;
; ;
;
(2)白色沉淀转化为淡黄色沉淀,发生沉淀的转化,AgCl转化为AgBr,离子反应为Br-+AgCl?AgBr+Cl-,
故答案为:Br-+AgCl?AgBr+Cl-;
(3)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,要想使氧化剂得到电子数等于还原剂失去电子数,则高锰酸根离子系数为2,草酸根离子系数为5,依据原子个数守恒,离子反应的方程式为2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,
故答案为:2;5;16H+;2;10;8H2O;
(4)现AlCl3的物质的量为0.03mol,完全生成Al(OH)3沉淀时,沉淀质量应为2.34g,现沉淀质量为0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n(Al(OH)3)=$\frac{0.78g}{78g/mol}$=0.01mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.01mol×3=0.03mol,
加入NaOH溶液的体积为$\frac{0.03mol}{4mol/L}$=0.0075L,即7.5mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
则由 Al3++3OH-═Al(OH)3↓
0.03mol 0.09mol 0.03mol
Al(OH)3+OH-═AlO2-+2H2O
(0.03-0.01)mol (0.03-0.01)mol
则消耗的碱的物质的量为0.09mol+(0.03-0.01)mol=0.11mol,
加入NaOH溶液的体积为$\frac{0.11mol}{4mol/L}$=0.0275L,即27.5mL;
故答案为:7.5mL或27.5mL.
点评 本题考查了电子式、化学方程式的书写、氧化还原方程式配平以及氢氧化铝的两性,明确双氧水结构、镁的化学性质、氧化还原反应得失电子守恒规律是解题关键,侧重考查学生分析问题、解决问题能力,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
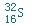 它的最高价氧化物对应的水化物的化学式:H2SO4.
它的最高价氧化物对应的水化物的化学式:H2SO4. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L苯中含有的分子数目为NA | |
| B. | 25℃、101 kPa时,20 g SO3中含有的原子数目为NA | |
| C. | 1 L 1 mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 16.8 g Fe与足量水蒸气反应,转移的电子数目为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1molCCl4含有的分子数为NA个 | |
| B. | 0.5mol/LNH4Cl溶液中NH4+的数目小于0.2NA个 | |
| C. | 16.0gCuS和CuO的混合物中含有的铜原子数为0.3NA | |
| D. | 向FeI2溶液中通过适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com