
| A. | CH3CH=CH2和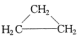 | B. | 乙炔和苯 | C. |  和 和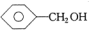 | D. | 乙酸和甲酸甲酯 |
分析 最简式指用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
同系物指结构相似,在分子组成上相差一个或若干个CH2原子团的物质;
同分异构体指具有相同的分子式,但具有不同的结构式的化合物.
解答 解:A.CH3CH=CH2和 分子式相同、结构不同,互为同分异构体,故A错误;
分子式相同、结构不同,互为同分异构体,故A错误;
B.乙炔和苯最简式相同,但既不是同系物,也不是同分异构体,又不含相同官能团,故B正确;
C. 和
和 分子式相同、结构不同,互为同分异构体,故C错误;
分子式相同、结构不同,互为同分异构体,故C错误;
D.乙酸和甲酸甲酯具有相同分子式、不同结构,二者互为同分异构体,故D错误;
故选B.
点评 本题据此看同系物、同分异构体等判断,题目难度不大,明确常见有机物组成与结构为解答关键,注意掌握同系物、同分异构体、最简式等概念,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制0.1mol•L-1氯化铝溶液 | 先将氯化铝晶体溶于浓盐酸中,后加蒸馏水稀释至指定体积 |
| B | 在加热条先下氢气还原氧化铜 | 反应完成后,先停止通入氢气,后停止加热 |
| C | 浓盐酸与碳酸钙反应制备CO2 | 气体产物先通过浓硫酸,后通过饱和碳酸氢钠溶液 |
| D | 检验某溶液是否含SO42- | 先加入BaCl2溶液,后加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com