
 ��1������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪNH4NO3$\stackrel{��}{?}$N2O+2H2O��ƽ�ⳣ������ʽΪK=c��N2O����c2��H2O��������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ4mol��
��1������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪNH4NO3$\stackrel{��}{?}$N2O+2H2O��ƽ�ⳣ������ʽΪK=c��N2O����c2��H2O��������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ4mol������ ��1�����������ķ�Ӧ��Ͳ�����Ԫ���غ���д����ʽ���ɣ����ݷ�Ӧ��дƽ�ⳣ������ʽ������������ԭ��Ӧ��ʧ�����غ����ת�Ƶ�������
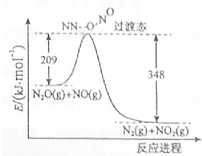
��2����ͼ��֪���˷�ӦΪ���ȷ�Ӧ����ЧӦ=��209-348��kJ•mol-1��
��� �⣺��1������立ֽ�����N2O��H2O���ﵽƽ�⣬˵��Ϊ���淴Ӧ����ѧ��Ӧ����ʽΪ��NH4NO3$\stackrel{��}{?}$N2O+2H2O��250��ʱ��ˮΪ����״̬����ƽ�ⳣ��K=c��N2O����c2��H2O����NH4NO3��NH4+��NԪ�ػ��ϼ�Ϊ-3�ۣ�NO3-�е�NԪ�صĻ��ϼ�Ϊ+5�ۣ���Ӧ��NԪ�صĻ��ϼ�Ϊ+1�ۣ��������з�Ӧ��NԪ����-3������Ϊ+1�ۣ��˷�Ӧ��ÿ�ֽ�1mol����泥�ת�Ƶ�����Ϊ4mol��
�ʴ�Ϊ��NH4NO3$\stackrel{��}{?}$N2O+2H2O��K=c��N2O����c2��H2O����4��
��2����ͼ��֪���˷�Ӧ��Ӧ������������������ҡ�H=209-348=-139kJ•mol-1�����Ȼ�ѧ����ʽΪ��N2O��g��+NO��g���TN2��g��+NO2��g����H=-139kJ•mol?1��
�ʴ�Ϊ��N2O��g��+NO��g���TN2��g��+NO2��g����H=-139kJ•mol?1��
���� ���⻯ѧƽ��ļ����Լ���ѧ��Ӧ�������仯��Ϊ��Ƶ���㣬ע�����ƽ�ⳣ�������壬�ѶȲ������ڿ���ѧ���ķ��������ͼ���������


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
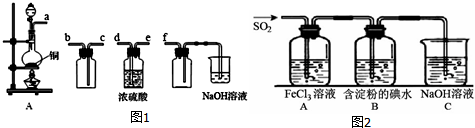
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | H2O��g���TH2��g��+$\frac{1}{2}$O2��g����H=+242kJ•mol-1 | B�� | 2H2��g��+O2��g��=2H2O��l����H=+484kJ•mol-1 | ||
| C�� | H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-242kJ•mol-1 | D�� | 2H2��g��+O2��g��=2H2O��g����H=-484kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
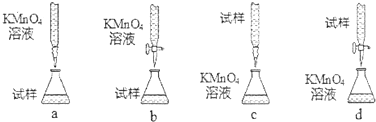
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
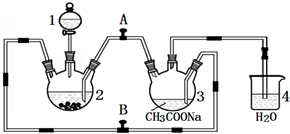 ���۸����ȶ������ױ����������������Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���ѣ����������ᣬ�dz��õ��������ռ���ʵ��������п����CrCl3��Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��
���۸����ȶ������ױ����������������Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���ѣ����������ᣬ�dz��õ��������ռ���ʵ��������п����CrCl3��Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
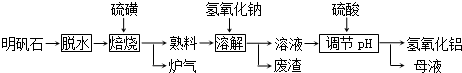
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��͢���;�����մﵽƽ��ʱ��ϵͳ�ڻ�������ƽ����Է���������ͬ | |
| B�� | ��͢���;�����մﵽƽ��ʱ��ϵͳ�ڻ������İٷ���ɲ�ͬ | |
| C�� | �ﵽƽ��ʱ��;����VA���ڢ�;����VA | |
| D�� | �ﵽƽ��ڢ�;��������ܶ�Ϊ�ڢ�;��������ܶȵ�$\frac{1}{2}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.01mol•L-1NH4Al��SO4��2��Һ��0.02mol•L-1Ba��OH��2��Һ�������ϣ�NH4++Al3++2SO42-+2Ba2++4OH-�T2BaSO4��+Al��OH��3��+NH3•H2O | |
| B�� | һ�������£���0.5mol N2��g����1.5molH2��g�������ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-38.6kJ•mol-1 | |
| C�� | 2H2��g��+O2��g���T2H2O��g����H=-571.6 kJ•mol-1����H2��ȼ����Ϊ571.6 kJ•mol-1 | |
| D�� | CO��g����ȼ������283.0 kJ•mol-1����CO2�ֽ���Ȼ�ѧ����ʽΪ��2CO2��g���T2CO��g��+O2��g����H=+283.0 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com