某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe
3+、Br
2的氧化性哪个更强?
(2)猜想:①甲同学认为氧化性:Fe
3+>Br
2,故上述实验现象是因为溶液中含
(填化学式,下同)所致.
②乙同学认为氧化性:Fe
3+<Br
2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
所致.
(3)设计实验并验证,丙同学为验证乙同学的观点,选用下列某些试剂,设计了两种方案进行实验.通过观察实验现象,证明乙同学的观点是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
(4)结论
氧化性:Fe
3+<Br
2.写出在足量的稀氯化亚铁溶液中加入1~2滴溴水的离子反应方程式
.
(5)结论应用
在2mol FeBr
2溶液中通入一定量的Cl
2,当有33.6L Cl
2(标准状况)与FeBr
2溶液发生反应时,所发生的离子反应方程式为
.
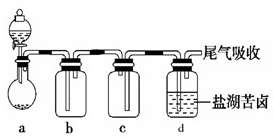
(6)某同学用图所示的实验装置制取氧化剂Cl
2并将其通入盐湖苦卤中.装置c在实验中的作用是
;若把上述装置中的a、c作为气体的发生、收集装置(a、c按图示从左至右直接相连),装置d可任意改进,则根据下列提供的药品,用这套装置可以制取的气体是
.(填序号)
A.制NH
3:浓氨水和碱石灰
B.制SO
2:Cu片和浓硫酸
C.制NO:Cu片和稀硝酸
D.制O
2:MnO
2和双氧水.

 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.