
【题目】海洋植物如海带、海藻中含有丰富的碘元素。从海带中提取碘的工业生产过程如下,下列说法错误的是

A. 过程①的分离方法是过滤,需要用到的玻璃仪器有漏斗、玻璃棒及烧杯
B. 加入NaOH溶液的目的是使可溶性有机质形成沉淀
C. 在氧化过程中可以选用氯水作为氧化剂
D. 过程②在工业上常采用萃取分液的方法得到碘单质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
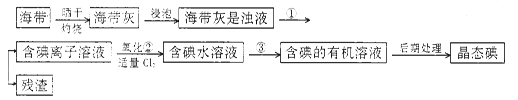
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中可用如图装置来制取干燥的氨气。

(1)写出A处发生反应的化学方程式_____________________________________。
(2)U形管B中所放的药品是__________________。
(3)实验室制取下列气体时,与实验室制取氨气的气体发生装置相同的是______________(填字母)。
A. 氢气 B.氧气C.氯气 D.二氧化碳
(4)试管C的管口处要放置一小团棉花,放置棉花的作用是___________________________。
(5)资料显示:“氨气可在纯氧中点燃,反应生成氮气和水”。为验证此事实,某同学设计了一个实验方案,装置见D。请写出该反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用草酸与浓硫酸反应制备CO,其原理如下:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅(黄色粉末)并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀),装置如图所示。
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅(黄色粉末)并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀),装置如图所示。
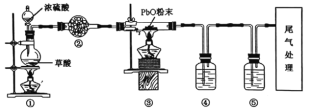
下列说法正确的是( )
A. ②、④、⑤中试剂依次为碱石灰、银氨溶液、澄清石灰水
B. ⑤中连续产生气泡且有明显现象时说明③中空气已排尽
C. 实验结束时,先熄灭①处酒精灯,再熄灭③处酒精灯
D. 实验过程中观察到③玻璃管中黄色粉末逐渐变成白色粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在生产生活中有广泛的用途,试回答下列回题:
(1)用浓硫酸在竹简表面“刻字”是利用浓硫酸的________性。
(2)工业上制取硫酸铜常采用铜与稀硫酸混合,通入空气并进行加热,请写出该反应的化学方程式_____________________;不采用铜跟浓硫酸反应来制取硫酸铜的原因是__________________________________。
(3)一定量的锌与含 a mol H2SO4的浓溶液充分反应后,锌完全溶解,同时收集到SO2与H2的混合气体bL(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)为 c mol/L,则混合物中SO2物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用硫铁矿(FeS2)焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
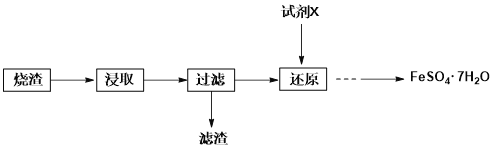
(1)试剂X可能为______________。
A.双氧水 B.酸性高锰酸钾 C.浓硫酸 D.SO2
(2)从还原后溶液中得到产品,应进行的操作是___________、____________、过滤、洗涤、干燥。
(3)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成500 mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,逐渐滴加0.0500 mol/L的酸性KMnO4溶液,至恰好完全反应,记录消耗的酸性KMnO4溶液的体积(假定药品中其他成分不与酸性KMnO4反应);
步骤c:重复步骤b2~3次,平均消耗酸性KMnO4溶液20.00mL。
已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则该补血剂中亚铁离子的含量为_____mg/片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A. SO2的摩尔质量是64g
B. 1 molSO2中所含分子数约为6.02×1023个
C. 1 molSO2的质量是64g/mol
D. 常温常压下,1 molSO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是

A. 起始滤液常温下pH﹥7 B. 试剂Ⅰ为BaCl2溶液
C. 上图过程必须经2次过滤 D. 步骤③目的是除去CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com