
 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是科目:高中化学 来源:不详 题型:多选题
| A.Z为0.3mol/L | B.Y2为0.35mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 CO2(g)+H2(g)的平衡常数K= 。
CO2(g)+H2(g)的平衡常数K= 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。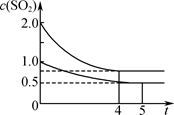
| A.热量:Q(甲)<2Q(乙) |
| B.压强:p(甲)<2p(乙) |
| C.乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1 |
| D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
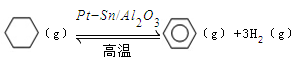 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。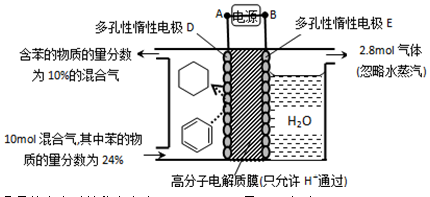
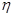 =_____(
=_____(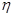 =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是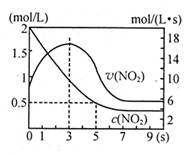
| A.5s时NO2的转化率为75% |
| B.0—3s时v(NO2)增大是由于体系温度升高 |
| C.3s时化学反应处于平衡状态 |
| D.9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com