
【题目】清华大学首创三室膜电解法制备LiOH,其工作原理如图。下列说法正确的是( )
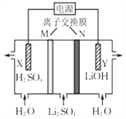
A. N为阳离子交换膜 B. X电极连接电源负极
C. 制备2.4gLiOH产生2.24LH2(标况) D. Y电极反应式为O2+2H2O+4e-=4OH-
【答案】A
【解析】该电解池实质是电解水,根据图知,Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,氢氧根浓度增大,故Y为电解池的阴极;X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,阳极反应式为2H2O-4e-=4H++O2↑。A.由图可知LiOH从最右侧导出,则Li+需通过N进入最右侧,故N为阳离子交换膜,故A正确;B.根据以上分析,X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,应与电源正极相连,故B错误;C.制备2.4gLiOH,n(OH-)=![]() =0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,为0.05mol×22.4L/mol=1.12L,故C错误;D.Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故D错误;故选A。
=0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,为0.05mol×22.4L/mol=1.12L,故C错误;D.Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故D错误;故选A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到( )
蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀.
A.①④⑥
B.②③④
C.②③⑤
D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷沸点由大到小的排列顺序正确的是( )
A. ①>②>③>④>⑤B. ⑤>④>③>②>①
C. ③>④>⑤>①>②D. ②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是关于农作物A、B在相同土壤中N、P、K三元素肥效实验的结果记录,“+”表示施肥,“―”表示未施肥)。请据表中的数据,判断正确的结论是( )
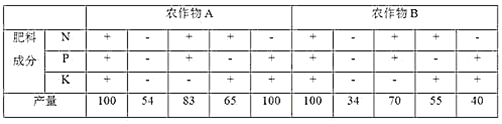
A. 对于农作物A来说,其生长发育不需要N元素
B. 对农作物A来说,施肥时最重要的是施加P肥
C. 对农作物B来说,三种元素中K最重要
D. 两种农作物对土壤中N、P、K的需求量基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1 mol/L K2SO4溶液中含有K+数目为 0.2NA
B. 将1 mL 5 mol/L的FeCl3溶液滴入100 mL沸水并继续煮沸至液体呈红褐色,所得分散系含胶粒数为0.005NA
C. 常温常压下,1.56 g Na2O2含有阴离子个数为0.02NA
D. 28 g铁粉与高温水蒸气反应,生成H2数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断正确的是( )
A. AB2分子的空间构型为直线形
B. AB2分子为极性分子
C. 熔点、沸点:AB2>H2O
D. AB2与SiO2的结构相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液_____NaHCO3溶液(填“>”、“<”或“=”)。
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=______。
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为___________(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是_____(填字母序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显_______性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
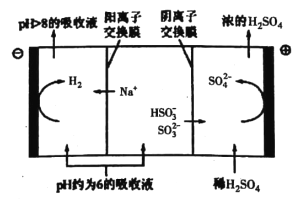
HSO3-在阳极放电的电极反应式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com