
| A. | 常温常压下,l.6gCH4中含有共价键总数为0.4NA | |
| B. | 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA | |
| C. | 1 L0.lmol•L-1的醋酸中含有H十离子数为0.1NA | |
| D. | 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA |
分析 A、求出甲烷的物质的量,然后根据甲烷中含4个C-H键来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、醋酸是弱电解质,在溶液中不能完全电离;
D、根据四氧化三铁中铁的价态为+$\frac{8}{3}$,而反应后变为0价来分析.
解答 解:A、1.6g甲烷的物质的量为0.1mol,而甲烷中含4个C-H键,故0.1mol甲烷中含0.4NA个C-H键,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故2.24L二氧化氮气体的物质的量小于0.1mol,且二氧化氮气体中存在平衡:2NO2?N2O4,故二氧化氮分子数小于0.1NA个,故B错误;
C、醋酸是弱电解质,在溶液中不能完全电离,故溶液中的氢离子的个数小于0.1NA个,故C错误;
D、四氧化三铁中铁的价态为+$\frac{8}{3}$,而反应后变为0价,故1mol四氧化三铁反应后转移8mol电子即8NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| D. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
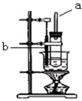 实验室制取硝基苯的装置如图所示.
实验室制取硝基苯的装置如图所示.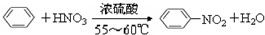 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
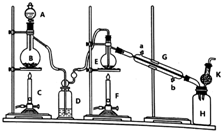 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com