
| A. | 光电池 | B. | 光导纤维 | C. | 石英钟表 | D. | 陶瓷餐具 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液、稀盐酸 | B. | NaCl溶液、KNO3溶液 | ||
| C. | Na2CO3溶液、澄清石灰水 | D. | Na2CO3溶液、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种液体都可以使干燥的布条褪色 | |
| B. | 两种液体都可以使干燥的蓝色石蕊试纸变红 | |
| C. | 用这两种液体都可给自来水消毒 | |
| D. | 分别向这两种液体中投人几颗金属锌粒均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
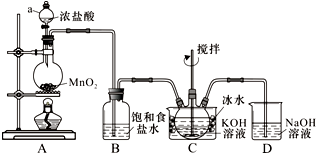 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 | |
| C. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com