
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:分析 X、Y、Z、R是原子序数依次增大的前四周期元素,XY2是形成酸雨的主要气体之一,则X是N元素,Y是O元素,XY2为NO2;Z基态原子的M层与K层电子数相等,M层电子数为1,故Z为Na;R2+的3d轨道有9个电子,R原子外围电子排布为3d104s1,故R为Cu元素.
解答 解:X、Y、Z、R是原子序数依次增大的前四周期元素,XY2是形成酸雨的主要气体之一,则X是N元素,Y是O元素,XY2为NO2;Z基态原子的M层与K层电子数相等,M层电子数为1,故Z为Na;R2+的3d轨道有9个电子,R原子外围电子排布为3d104s1,故R为Cu元素.
(1)R2+的3d轨道有9个电子,则R基态原子的电子排布式是:[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)Z所在周期为第三周期,同周期随原子序数增大,元素第一电离能呈增大趋势,第三周期中第一电离能最大的主族元素是Cl,
故答案为:Cl;
(3)NO2-离子中N原子孤电子对数为$\frac{5+1-2×2}{2}$=1,价层电子对数=2+1=3,故为V形结构,
故答案为:V形;
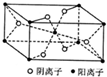
(4)晶胞中阴离子数目为2+4×$\frac{1}{2}$=4、阳离子的个数为1+8×$\frac{1}{8}$=2,则阴离子与阳离子个数之比为4:2=2:1,
故答案为:2:1;
(5)将R单质的粉末加入X气态氢化物的浓溶液中,不断鼓入空气充分反应,得到深蓝色的[Cu(NH3)4](OH)2溶液,该反应的离子方程式是:8NH3+2Cu+O2+2H2O=2[Cu(NH3)4]2++4OH-,[Cu(NH3)4]2+中含有4个配位键、12个N-H将,则1mol[Cu(NH3)4]2+中含有的σ键的数目是16mol,
故答案为:8NH3+2Cu+O2+2H2O=2[Cu(NH3)4]2++4OH-;16mol.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、的路程、空间构型、晶胞计算、配合物等,掌握均摊法进行晶胞有关计算.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
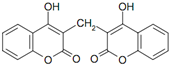
| A. | 分子式为C19H10O6 | |
| B. | 遇FeCl3溶液能发生显色反应 | |
| C. | 1 mol双羟香豆素最多能与含 4 mol氢氧化钠的水溶液完全反应 | |
| D. | 1 mol双羟香豆素最多能与 10 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3Cl2(g)+8NH3(g)═6NH4Cl(s)+N2(g)在常温下能自发进行,则该反应的△H<0 | |
| B. | 电解精炼铜时,电解液中CuSO4的物质的量浓度不变 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com