
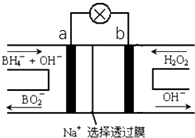
 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )| A. | 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 | |
| B. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 电池放电时Na+从b极区移向a极区 | |
| D. | 电池的负极反应为BH4-+2H2O-8e-═BO2-+8H+ |
分析 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和解答该题.
解答 解:A.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,每转移2mol电子,理论上需要消耗0.25mol即9.5gNaBH4,故A正确;
B.电极b采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故C错误;
D.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D错误;
故选A.
点评 本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
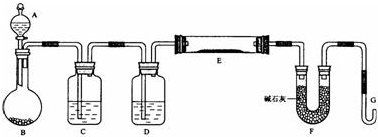
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
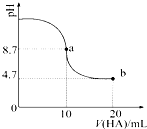 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10mL时,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
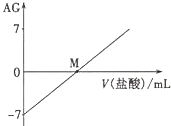 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )| A. | 室温下,0.01 mol•L-l盐酸的AG=12 | B. | M点时溶液中:c(NH4+)=c(Cl-) | ||
| C. | M点加入盐酸的体积大于20.00 mL | D. | M点以后NH4+的水解程度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com