
 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: .
.分析 (1)化合物N2H4为共价化合物,含有N-N、N-H键;
(2)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(3)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的;
(4)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(5)Na3AsO4属于离子化合物,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,据此判断空间构型;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(6)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)化合物N2H4为共价化合物,含有N-N、N-H键,电子式为 ,故答案为:
,故答案为: ;
;
(2)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(3)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的,第一电离能大于硫的,
故答案为:P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大;
(4)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(5)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
故答案为:离子键、共价键;正四面体;sp3;
(6)根据均摊法可知,晶胞中P4分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×$\frac{31}{{N}_{A}}$g,晶胞体积为(a cm)3,则晶胞密度为$\frac{4×\frac{31}{{N}_{A}}g}{(acm)^{3}}$=$\frac{496}{{a}^{3}{N}_{A}}$g.cm-3,
故答案为:16;$\frac{496}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,为高频考点,侧重考查学生的分析能力、计算能力,涉及核外电子排布、电离能、价层电子对互斥联立、杂化方式与空间构型判断、化学键、晶胞计算等,是对物质结构主干知识的考查,需要学生具备扎实的基础与灵活运用能力,难度中等,掌握均摊法进行有关晶胞计算.


科目:高中化学 来源: 题型:选择题
 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;F含有的官能团名称是羧基、羟基.
;F含有的官能团名称是羧基、羟基. .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
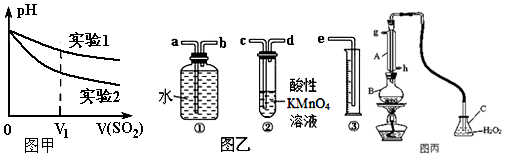
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 电解质溶液的电导率越大,导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度 均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温 Ksp[(CH3)2NH•H2O3=1.6×l04),利用传感器测得滴定过程中溶液的电导率如图所示》下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度 均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温 Ksp[(CH3)2NH•H2O3=1.6×l04),利用传感器测得滴定过程中溶液的电导率如图所示》下列说法正确的是( )| A. | b、c、d三点的溶液中水的电离程度:b<d<c | |
| B. | a 点溶液中:c(Na+)=2c(OH-)-2c(H+) | |
| C. | d 点溶液中:c[(CH3)2NH2+]+c(H+)-(OH-)=0.100mol•L-1 | |
| D. | e 点溶液中:c(H+)>c[(CH3)2NH2+]+2c[(CH3)2NH•H2O] |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有 3-14% Se 元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金 属及贵金属.从阳极泥中提取Se 的流程如下:
属及贵金属.从阳极泥中提取Se 的流程如下:

已知:SeO2在773K时为气态
(1)流程②的作用 工业提取 Se 的流程中,可循环利用的物质是
(2)H2SeO3与SO2的离子反应方程式为 .
(3)上述工业提取 Se 的流程中,SeO2、H2SO4 (浓)、SO2 的氧化性由强到弱的顺序是
(4)单质硒可能成为环境污染物,可通过与浓HNO3反应生成SeO2来回收Se,Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式: 如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com