
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |
分析 制取硝酸铜有关反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O,结合方程式分析.
解答 解:A.Cu与4HNO3(浓)反应,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成物二氧化氮有毒,会污染环境,故A错误;
B.Cu与HNO3(稀)反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成物NO有毒,会污染环境,故B错误;
C.Cu在空气加热后生成CuO,再将CuO与硝酸反应,反应方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O,生成物对环境无影响,原料利用率高,故C正确;
D.CuCl2与硝酸不反应,不能生成硝酸铜,故D错误.
故选C.
点评 本题考查硝酸铜的制备方案的评价,注意根据相关反应的化学方程式结合环保进行分析是解答的关键,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2HCl═2NaCl+H2↑ | |
| B. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| C. | CuO+H2SO4═CuSO4+H2O | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
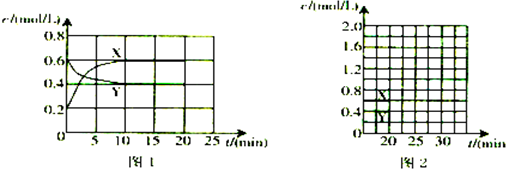
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
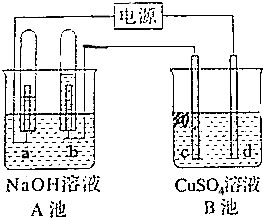 如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )
如图所示,A池用石墨电极电解pH=13的Na0H溶液100mL,B池为模拟电解精炼铜的装置,其中c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止电解,A池a极上产生的气体在标准状况下为2.24L,则下列说法正确的是( )| A. | d电极质量一定减少6.4g | B. | c电极质量一定增加6.4g | ||
| C. | A池pH不变 | D. | A池溶液质量减少3.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定等于0.1mol/L | B. | 一定大于0.1mol/L | ||
| C. | 一定小于0.1mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.2 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 0~t1 min内的平均反应速率v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 平衡时CO的转化率为66.67% | |
| C. | t1时刻该反应处于平衡状态 | |
| D. | t2时刻CO的浓度为0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,0.5molN2和1.5molH2置于密闭容器中充分反应生成氨气,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |
| D. | 酸碱发生中和反应生成1mol液态H2O时,所放出的热量称为中和热,可表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com