
| A. | 计算机芯片的组成元素位于第14纵行 | |
| B. | 第10纵行元素全部是金属元素 | |
| C. | 第3纵行元素的种类最多 | |
| D. | 只有第2纵行元素的原子最外层有2个电子 |
分析 由左到右按原顺序编为18纵行.如碱金属为第1纵行,稀有气体为第18纵行,则Si位于第14列,第3列含锕系和镧系,第10列为第ⅤⅢ族元素,第2列为碱土金属元素,以此来解答.
解答 解:A.计算机芯片的组成元素为Si,位于第14纵行,故A正确;
B.第10纵行为第ⅤⅢ族元素,全部是金属元素,故B正确;
C.第3纵行含锕系和镧系,含元素的种类最多,故C正确;
D.第2纵行元素、He及某些过渡元素的原子最外层有2个电子,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、周期表的结构为解答的关键,侧重分析与应用能力的考查,注意原子结构与元素的位置,题目难度不大.


科目:高中化学 来源: 题型:解答题
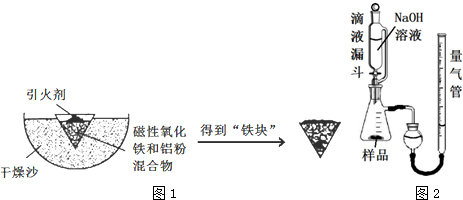
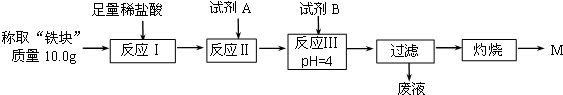
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
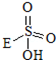 →
→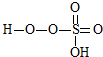 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硼元素的质量数是10 | B. | 10B20具有较强的化学活性 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B的中子数与核外电子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
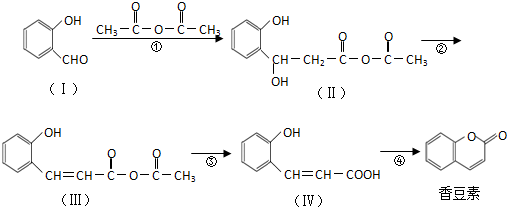
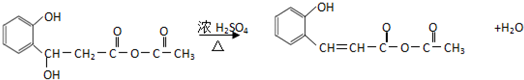 .
.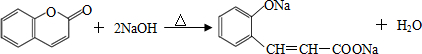 .
. (任意2种)(任写两种).
(任意2种)(任写两种).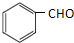 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
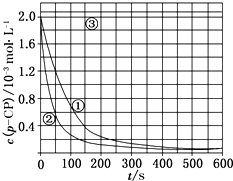 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com