
 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广.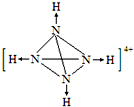 .
. 分析 (1)①非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大;
②醋酸二氨合铜所含元素组成的单质,有铜、金刚石、氧气、氢气等;
③Cu的外围电子排布为3d104s1,只有1个未成对电子;
(2)根据分子中中心原子的价层电子对数判断杂化类型和分子的空间构型;
(3)①a.分子式相同结构不同的化合物互称同分异构体;
b.一个N2中含有2个 π键;
c.结构相似的分子晶体,相对分子量越大,熔沸点越高;
d.同主族从上到下,非金属性减弱;
②N4H44+中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键.
解答 解:(1)①非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大,醋酸二氨合铜所含的元素有Cu、O、C、H、N,由于N原子的最外层排布为半满状态,第一电离能较大,所以第一电离能最大的是N;
故答案为:氮;
②醋酸二氨合铜所含元素组成的单质,有铜属于金属晶体、金刚石属于原子晶体、氧气和氢气属于分子晶体;
故答案为:b、c、d;
③Cu的外围电子排布为3d104s1,只有1个未成对电子,第4周期元素中,基态原子含有一个未成对电子的元素有,K、Sc、GaBr,共有4种元素;
故答案为:4;
(2)①BF3中B的价层电子对数为3+$\frac{3-3×1}{2}$=3,没有孤电子对,分子的空间构型为正三角形,NH3分子中N原子的价层电子对数为3+$\frac{5-3×1}{2}$=4,含有一个孤电子对,空间构型为三角锥型;
故答案为:正三角形;三角锥型;
②晶体F3B-NH3中,B原子的价层电子对数为4,则杂化类型为sp3杂化;
故答案为:sp3;
(3)①a.分子式相同结构不同的化合物互称同分异构体,N4与N2都是N元素的单质,属于同素异形体,故a错误;
b.一个N2中含有2个 π键,1mol N4 分解生成2molN2,形成了4mol π键,故b正确;
c.结构相似的分子晶体,相对分子量越大,熔沸点越高,白磷的相对分子量比N4大,与键能无关,故c错误;
d.同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比N2活泼,与共价键稳定性有关,故d错误;
故答案为:b;
②N4H44+中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则N4H44+的结构图为 ;
;
故答案为: .
.
点评 本题考查了晶体类型和第一电离能、杂化方式的判断、电子排布式的书写、电负性、微粒的空间结构、配位键等;考查的知识点较多,题目难度中等,注意对题中所给结构图的分析是解题的关键.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
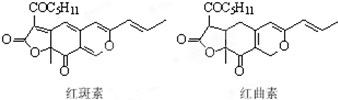 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )| A. | 红斑素和红曲素互为同分异构体 | |
| B. | 一定条件下红斑素和红曲素都能发生加聚和缩聚反应 | |
| C. | 红斑素中含有醚键、羰基、酯键这三种含氧官能团 | |
| D. | 1 mol红曲素最多能与6 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
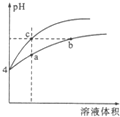 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )| A. | a、b、c三点溶液的Kw相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的铜的物质的量是0.2mol | B. | 随着电解进行溶液的pH减小 | ||
| C. | 转移电子的物质的量为0.4mol | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
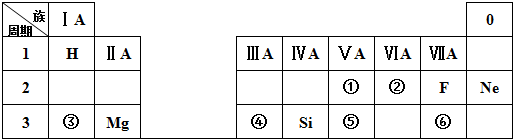
 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com