
| A. | 2-乙基戊烷 | B. | 3-甲基-2-戊烯 | C. | 2-甲基-3-戊炔 | D. | 1-甲基-5-乙基苯 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.2-乙基戊烷,戊烷的命名中出现2-乙基,说明选取的主链不是最长碳链,该有机物最长碳链含有6个C,主链为己烷,在3号C含有1个甲基,该有机物正确命名为:3-甲基己烷,故A错误;
B.3-甲基-2-戊烯,主链为2-戊烯,在3号C含有1个甲基,该命名合理,故B正确;
C.2-甲基-3-戊炔,炔烃的命名编号必须从距离碳碳双键最近的一端开始,碳碳三键在2号C,甲基在3号C,正确的命名为:3-甲基-2-戊炔,故C错误;
D.1-甲基-5-乙基苯,该命名不满足取代基的编号之和最小,正确命名应该为:1-甲基-2-乙基苯,故D错误;
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气混合 | B. | 乙烯与氯化氢混合 | ||
| C. | 乙烯与氯气混合 | D. | 乙炔与氯气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
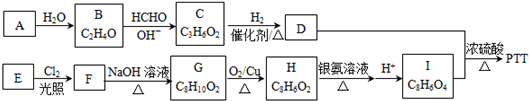
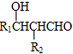
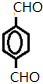 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
.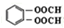 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
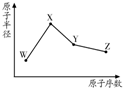 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com