
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬½«µČĮæµÄĘųĢå·Ö±šĶØČėĘšŹ¼ČŻ»żĻąĶ¬µÄĆܱÕČŻĘ÷¢ńŗĶ¢ņÖŠ£¬Ź¹Ęä·¢Éś·“Ó¦£¬t0Ź±ČŻĘ÷¢ńÖŠ“ļµ½»ÆŃ§Ę½ŗā£¬X”¢Y”¢ZµÄĪļÖŹµÄĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠÓŠ¹ŲĶʶĻÕżČ·µÄŹĒ

A.øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ3X£«2Y2Z
B.ČōĮ½ČŻĘ÷ÖŠ¾ł“ļµ½Ę½ŗāŹ±£¬Į½ČŻĘ÷ÖŠZµÄĪļÖŹµÄĮæ·ÖŹżĻąĶ¬£¬ŌņYĪŖ¹ĢĢå»ņŅŗĢå
C.ČōĮ½ČŻĘ÷ÖŠ¾ł“ļµ½Ę½ŗāŹ±£¬Į½ČŻĘ÷µÄĢå»żV(¢ń)£¼V(¢ņ)£¬ŌņČŻĘ÷¢ņ“ļµ½Ę½ŗāĖłŠčŹ±¼äŠ”ÓŚt0
D.Čō“ļĘ½ŗāŗ󣬶ŌČŻĘ÷¢ņÉżøßĪĀ¶ČŹ±£¬ĘäĢå»żŌö“ó£¬ĖµĆ÷Z·¢ÉśµÄ·“Ó¦ĪŖĪüČČ·“Ó¦
”¾“š°ø”æB
”¾½āĪö”æ
A£®øł¾ŻX”¢Y”¢ZĪļÖŹµÄĮæµÄ±ä»ÆĶ¼Ļó·ÖĪö£¬ZŹĒ·“Ó¦Īļ£¬X”¢YŹĒÉś³ÉĪļ£¬µ½Ę½ŗāŗó£¬XÉś³É1.8mol£¬YÉś³É1.2mol£¬Z·“Ó¦1.8mol£¬Ōņ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ3Z3X+2Y£¬¹ŹA“ķĪó£»
B£®ČōĮ½ČŻĘ÷ÖŠ¾ł“ļµ½Ę½ŗāŹ±£¬Į½ČŻĘ÷ÖŠZµÄĪļÖŹµÄĮæ·ÖŹżĻąĶ¬£¬ĖµĆ÷“ļµ½ĻąĶ¬µÄĘ½ŗā£¬²»ŹÜŃ¹ĒæµÄ±ä»ÆÓ°Ļģ£¬ĖłŅŌ·“Ó¦Ē°ŗóĘųĢåĢå»żÓ¦ŹĒ²»±äµÄ·“Ó¦£¬ĖłŅŌXŗĶZĪŖĘųĢ壬¶ųYĪŖ¹ĢĢ¬»ņŅŗĢ¬£¬¹ŹBÕżČ·£»
C£®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ3Z3X+2Y£¬ČōĮ½ČŻĘ÷ÖŠ¾ł“ļµ½Ę½ŗāŹ±£¬Į½ČŻĘ÷µÄĢå»żV(¢ń)£¼V(¢ņ)£¬ŌņČŻĘ÷¢ņ“ļµ½Ę½ŗāŹ±Ģå»żŌö“ó£¬Ń¹Ēæ¼õŠ”µÄ¹ż³Ģ£¬“ļµ½Ę½ŗāĖłŠčŹ±¼ä“óÓŚt0£¬¹ŹC“ķĪó£»
D£®Čō“ļĘ½ŗāŗó£¬ČŻĘ÷¢ņŹĒŗćŃ¹ČŻĘ÷£¬ÉżøßĪĀ¶ČŹ±ĘäĢå»żŌö“󣬵«²»ÄÜĖµĆ÷Ę½ŗāÕżĻņ½ųŠŠ£¬Z·¢ÉśµÄ·“Ó¦²»Ņ»¶ØĪŖĪüČČ·“Ó¦£¬¹ŹD“ķĪó£»
¹Ź“š°øĪŖB”£


 ²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø
²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø µć¾¦ŠĀ½Ģ²ÄČ«Äܽā¶ĮĻµĮŠ“š°ø
µć¾¦ŠĀ½Ģ²ÄČ«Äܽā¶ĮĻµĮŠ“š°ø Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĻĮŃ1mol»Æѧ¼üĖłŠčŅŖµÄÄÜĮæČēĻĀ:
»Æѧ¼ü | N-N | O=O | N”ŌN | N-H |
¼üÄÜkJ”¤mol£1 | a | 500 | 942 | 391 |
ėĀ£ØN2H4£©µÄÓŠ¹Ų·“Ó¦ÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A. øĆĶ¼±ķŹ¾:1molN2H4Óė1molO2·“Ӧɜ³É1molN2ŗĶ2molH2O·“Ó¦ČČ”÷H=£2752kJ”¤mol£1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) ”÷H=+2752kJ”¤mol£1
D. µ±ÓŠ2molH2O(g)Éś³ÉŹ±£¬·Å³ö534kJ”¤mol£1µÄČČĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬ÓÉCO2Öʱø¼×“¼µÄ¹ż³ĢæÉÄÜÉę¼°µÄ·“Ó¦ČēĻĀ£ŗ·“Ó¦¢ń£ŗCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ”÷H1=-49.58kJ”¤mol-1
CH3OH(g)+H2O(g) ”÷H1=-49.58kJ”¤mol-1
·“Ó¦¢ņ£ŗCO2(g)+H2(g)![]() CO(g)+H2O(g) ”÷H2
CO(g)+H2O(g) ”÷H2
·“Ó¦¢ó£ŗCO(g)+2H2(g)![]() CH3OH(g) ”÷H3=-90.77kJ”¤mol-1
CH3OH(g) ”÷H3=-90.77kJ”¤mol-1
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦¢ņµÄ”÷H2=______________”£
£Ø2£©·“Ó¦¢óÄܹ»×Ō·¢½ųŠŠµÄĢõ¼žŹĒ__________ (Ģī”°½ĻµĶĪĀ¶Č”±”¢”° ½ĻøßĪĀ¶Č”±»ņ”°ČĪŗĪĪĀ¶Č”±)
£Ø3£©ŗćĪĀ£¬ŗćČŻĆܱÕČŻĘ÷ÖŠ£¬¶ŌÓŚ·“Ó¦¢ń£¬ĻĀĮŠĖµ·ØÖŠÄÜĖµĆ÷øĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ________”£
A.»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ
B.»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
C.CO2”¢H2”¢CH3OH”¢H2OµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ3£ŗ1£ŗ1
D.¼×“¼µÄ°Ł·Öŗ¬Įæ²»ŌŁ±ä»Æ
£Ø4£©¶ŌÓŚ·“Ó¦¢ń£¬²»Ķ¬ĪĀ¶Č¶ŌCO2µÄ×Ŗ»ÆĀŹ¼°“߻ƼĮµÄŠ§ĀŹÓ°ĻģČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ__________”£

A.ĘäĖūĢõ¼ž²»±ä£¬Čō²»Ź¹ÓĆ“ß»Æ¼Į£¬Ōņ250”ꏱCO2µÄĘ½ŗā×Ŗ»ÆĀŹæÉÄÜĪ»ÓŚM1
B.ĪĀ¶ČµĶÓŚ250”ꏱ£¬ĖęĪĀ¶ČÉżø߼ד¼µÄ²śĀŹŌö“ó
C.MµćŹ±Ę½ŗā³£Źż±ČNµćŹ±Ę½ŗā³£Źż“ó
D.Źµ¼Ź·“Ó¦Ó¦¾”æÉÄÜŌŚ½ĻµĶµÄĪĀ¶ČĻĀ½ųŠŠ£¬ŅŌĢįøßCO2µÄ×Ŗ»ÆĀŹ
£Ø5£©ČōŌŚ1LĆܱÕČŻĘ÷ÖŠ³äČė3molH2ŗĶ1molCO2·¢Éś·“Ó¦¢ń£¬250”ꏱ·“Ó¦µÄĘ½ŗā³£ŹżK=______£»ČōŅŖ½ųŅ»²½Ģįø߼ד¼Ģå»ż·ÖŹż”£æɲÉČ”µÄ“ėŹ©ÓŠ_________________”£
£Ø6£©ĻĀĶ¼ŹĒµē½āNa2CO3ČÜŅŗµÄ×°ÖĆĶ¼”£

Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŅ¹śæĘѧ¼Ņ·¢Ć÷ĮĖŅ»ÖÖ°²Č«æɳäµēµÄČįŠŌĖ®ĻµÄĘĄė×Óµē³Ų£¬æÉÓĆÉśĄķŃĪĖ®»ņĻø°ūÅąŃų»łĪŖµē½āÖŹ£¬µē³Ų·ÅµēµÄ×Ü·“Ó¦Ź½ĪŖ£ŗNa0.44MnO2+NaTi2(PO4)3=Na0.44£xMnO2+Na1+xTi2(PO4)3£¬Ę乤×÷ŌĄķČēĻĀĶ¼”£

ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A. ·ÅµēŹ±£¬Cl£ĻņX¼«ŅʶÆ
B. øƵē³Ų³äµēŹ±Y¼«Ó¦øĆÓėµēŌ“µÄÕż¼«ĻąĮ¬
C. ³äµēŹ±£¬Ņõ¼«·“Ó¦ĪŖ£ŗNaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. øƵē³ŲæÉÄÜ×÷ĪŖæÉÖ²ČėČĖĢåµÄµē×ÓŅ½ĮĘÉč±øµÄµēŌ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±£ĻÕ·Ū(Na2S2O4)¹ć·ŗÓ¦ÓĆÓŚŌģÖ½”¢Ó”Č¾”¢»·±£”¢Ņ½Ņ©µČŠŠŅµ”£øĆĪļÖŹ¾ßÓŠĒ滹ŌŠŌ£¬ŌŚæÕĘųÖŠŅ×±»Ńõ»Æ£¬ŹÜČČŅ×·Ö½ā£¬ŌŚ¼īŠŌĢõ¼žĻĀ±Č½ĻĪČ¶Ø£¬Ņ×ČÜÓŚĖ®”¢²»ČÜÓŚŅŅ“¼”£±£ĻÕ·ŪæÉŅŌĶعż NaHSO3ÓėNaBH4·“Ó¦ÖĘČ””£Ēė°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
I£®NaHSO3ČÜŅŗµÄÖʱø

(1)ÉĻĶ¼ŅĒĘ÷aµÄĆū³Ę___________£»×°ÖĆCÖŠ·“Ó¦ŗóČÜŅŗpH=4.1£¬Ōņ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________”£
II£®±£ĻÕ·ŪµÄÖʱø
“ņæŖĻĀĶ¼(²æ·Ö×°ÖĆŅŃŹ”ĀŌ)ÖŠ»īČūK1ĶØČėµŖĘų£¬Ņ»¶ĪŹ±¼äŗ󣬹Ų±ÕK1£¬“ņæŖŗćŃ¹µĪŅŗĀ©¶·»īČūĻņ×°ÖĆEÖŠµĪČė¼īŠŌNaBH4ČÜŅŗ£¬ŌŚ30-40”ęĻĀ³ä·Ö·“Ó¦”£Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČėŅŅ“¼£¬¾ĄäČ“½į¾§”¢¹żĀĖµĆµ½Na2S2O4”¤2H2O¾§Ģ壬ŌŁÓĆŅŅ“¼Ļ“µÓ”¢ÕęæÕŗęøÉĶŃČ„¾§Ģå½į¾§Ė®µĆµ½±£ĻÕ·Ū”£

(2)·“Ó¦²śĪļÖŠÓŠNaBO2£¬ĪŽĘųĢ唣Š“³öEÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½___________”£
(3)ĶØČėµŖĘųµÄ×÷ÓĆŹĒ______________________”£
(4)Ź¹ÓĆŅŅ“¼Ļ“µÓNa2S2O4”¤2H2O¾§ĢåµÄÓŵć£ŗ______________________”£
(5)¶Ō×°ÖĆEµÄ¼ÓČČ·½Ź½×īŗĆ²ÉÓĆ______________________”£
¢ó£®±£ĻÕ·ŪµÄ“æ¶Č²ā¶Ø
(6)³ĘČ”2.0g Na2S2O4ѳʷČÜÓŚĄäĖ®Åä³É200mLČÜŅŗ£¬Č”³ö25.00mLøĆČÜŅŗӌ׶ŠĪĘæÖŠ£¬ÓĆ0.10mol/L¼īŠŌK3[Fe(CN)6]±ź×¼ČÜŅŗµĪ¶Ø£¬ŌĄķĪŖ£ŗ4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O£¬ÓĆŃĒ¼×»łĄ¶ĪŖÖøŹ¾¼Į£¬“ļµ½µĪ¶ØÖÕµćŹ±Ļūŗıź×¼ČÜŅŗ24.00mL£¬Ōņѳʷ֊Na2S2O4µÄÖŹĮæ·ÖŹżĪŖ___________(ŌÓÖŹ²»²ĪÓė·“Ó¦)(¼ĘĖć½į¹ū¾«Č·ÖĮ0.1%)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĢśæóŹÆ(Fe2O3)£¬æÉŅŌÖʵĆFe3[Fe(CN)6]2ŗĶFe(SCN)3£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)»łĢ¬Fe3+µÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ___________”£
(2)O”¢S”¢CČżÖÖŌŖĖŲµÄµēøŗŠŌÓɓ󵽊”µÄĖ³ŠņĪŖ___________£¬Fe(CO)5ŹĒŅ»ÖÖĒ³»ĘÉ«ŅŗĢ壬ČŪµć£20”ę£¬·Šµć103”ę”£Fe(CO)5¾§ĢåĄąŠĶŹĒ___________”£
(3)KSCNŹĒ¼ģŃéFe3+µÄŹŌ¼ĮÖ®Ņ»£¬ÓėSCN£»„ĪŖµČµē×ÓĢåµÄ·Ö×ÓĪŖ___________(ČĪŠ“Ņ»ÖÖ)£¬SCN£ÖŠĢ¼Ō×ÓµÄŌÓ»ÆĄąŠĶĪŖ___________”£µŚŅ»µēĄėÄÜI1(N)___________I1(O)(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)£¬ĄķÓÉŹĒ___________”£
(4)¼Ų¾§Ģå(Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾)µÄ¾§°ū²ĪŹżĪŖapm”£¼Ł¶Ø½šŹō¼ŲŌ×ÓĪŖµČ¾¶µÄøÕŠŌŠ”ĒņĒŅ“¦ÓŚĢå¶Ō½ĒĻßÉĻµÄČżøöĒņĻąĒŠ£¬Ōņ¼ŲŌ×ӵİė¾¶ĪŖ___________pm£¬¾§Ģå¼ŲµÄĆÜ¶Č¼ĘĖćŹ½ŹĒ___________g/m3(ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ)

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷æÉ“ļµ½ŹµŃéÄæµÄµÄŹĒ
A. ÓĆ³¤¾±Ā©¶·æÉ·ÖĄėŅŅĖįŅŅõ„ŗĶ±„ŗĶĢ¼ĖįÄĘČÜŅŗ
B. ½«NaOHČÜŅŗµĪ¼Óµ½FeCl3ČÜŅŗÖŠæÉÖʱøFe(OH)3½ŗĢå
C. ÓĆÅØŃĪĖįŗĶMnO2·“Ó¦Öʱø“æ¾»µÄCl2£¬ĘųĢå²śĪļĻČĶعżÅØĮņĖįŌŁĶعż±„ŗĶŹ³ŃĪĖ®
D. ³żČ„Na2CO3¹ĢĢåÖŠµÄNaHCO3£¬æɽ«¹ĢĢå¼ÓČČÖĮŗćÖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»·¶”»ł¼×ĖįŹĒÖŲŅŖµÄÓŠ»śŗĻ³ÉÖŠ¼äĢ壬ĘäŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
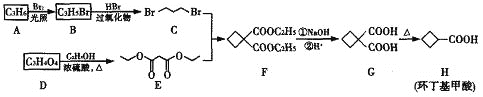
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)»·¶”»ł¼×ĖįµÄ·Ö×ÓŹ½ĪŖ____________________”£
(2)»·¶”»ł¼×ĖįÓÉŌĮĻAŗĶD¾Ņ»ĻµĮŠ·“Ó¦ÖĘµĆ£¬AĪŖĻ©Ģž£¬ŌņAµÄĆū³ĘĪŖ______£¬DĪļÖŹµÄ¹ŁÄÜĶÅĪŖ_______”£
(3)Š“³öD”śEµÄ»Æѧ·½³ĢŹ½________________________”£
(4)C+E”śFµÄ·“Ó¦ĄąŠĶĪŖ_________________________”£
(5)»ÆŗĻĪļWĪŖHµÄĶ¬·ÖŅģ¹¹Ģ壬ÄÜ·¢ÉśŅų¾µ·“Ó¦ĒŅÖ»ŗ¬õ„»łŅ»ÖÖ¹ŁÄÜĶÅ£¬ŌņĖłÓŠ·ūŗĻĢõ¼žµÄWµÄ½į¹¹¼ņŹ½ĪŖ_____________”£
(6)²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬ŅŌ ![]() ŗĶEĪŖŌĮĻ(ĪŽ»śŹŌ¼ĮČĪŃ”)£¬Éč¼ĘÖʱø
ŗĶEĪŖŌĮĻ(ĪŽ»śŹŌ¼ĮČĪŃ”)£¬Éč¼ĘÖʱø![]() µÄŗĻ³ÉĀ·Ļߣŗ__________”£
µÄŗĻ³ÉĀ·Ļߣŗ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×é½ųŠŠŹµŃé£ŗĻņĮņĖįĖį»ÆµÄ¹żŃõ»ÆĒāČÜŅŗÖŠ¼ÓČėµā»Æ¼Ų”¢µķ·ŪŗĶĮņ“śĮņĖįÄʵĻģŗĻČÜŅŗ£¬Ņ»¶ĪŹ±¼äŗóČÜŅŗ±äĄ¶”£²éŌÄ׏ĮĻÖŖĢåĻµÖŠ“ęŌŚĮ½øöÖ÷ŅŖ·“Ó¦£ŗ
·“Ó¦i£ŗH2O2(aq) + 2I£(aq) + 2H+(aq) I2(aq) + 2H2O(l) ¦¤H1 = -247.5 kJ/mol
·“Ó¦ii£ŗI2(aq) + 2S2O32-(aq) 2I£(aq) + S4O62-(aq) ¦¤H2 = -1021.6 kJ/mol
£Ø1£©H2O2ÓėS2O32-·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ______”£
£Ø2£©ĻĀĮŠŹµŃé·½°øæÉÖ¤ŹµÉĻŹö·“Ó¦¹ż³Ģ”£½«ŹµŃé·½°ø²¹³äĶźÕū£ØĖłÓĆŹŌ¼ĮÅØ¶Č¾łĪŖ0.01 mol/L£©”£
a£®ĻņĖį»ÆµÄH2O2ČÜŅŗÖŠ¼ÓČė________ČÜŅŗ£¬ČÜŅŗ¼øĆėŗó±äĪŖĄ¶É«”£
b£®_________£¬ČÜŅŗĮ¢¼“ĶŹÉ«”£
£Ø3£©Ģ½¾æc(H+)¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ£¬ŹµŃé·½°øČēĻĀ±ķĖłŹ¾”££ØĖłÓĆŹŌ¼Į³żH2OŅŌĶā£¬ÅØ¶Č¾łĪŖ0.01 mol/L£©
ŹµŃéŠņŗÅ | a | b | |
ŹŌ ¼Į | H2O2/mL | 5 | ______ |
H2SO4/mL | 4 | 2 | |
Na2S2O3/mL | 8 | _____ | |
KI£Øŗ¬µķ·Ū£©/mL | 3 | _____ | |
H2O | 0 | ______ | |
½«ÉĻŹöČÜŅŗŃøĖŁ»ģŗĻ ¹Ū²ģĻÖĻó | ČÜŅŗ±äĄ¶ĖłŠčŹ±¼ä ĪŖt1Ćė | ČÜŅŗ±äĄ¶ĖłŠčŹ±¼ä ĪŖt2Ćė | |
¢Ł ½«ŹµŃéb²¹³äĶźÕū”£
¢Ś ¶Ō±ČŹµŃéaŗĶŹµŃéb£¬t1_____t2£ØĢī”°>”±»ņ”°<”±£©”£
¢Ū ½įŗĻ£Ø2£©ÖŠĻÖĻó½āŹĶČÜŅŗ»ģŗĻŗóŅ»¶ĪŹ±¼ä²Å±äĄ¶µÄŌŅņ________”£
¢Ü ĄūÓĆŹµŃéaµÄŹż¾Ż£¬¼ĘĖćt1Ź±¼äÄŚH2O2ÓėS2O32-·“Ó¦µÄĘ½¾ł·“Ó¦ĖŁĀŹ£ØÓĆH2O2ÅØ¶ČµÄ±ä»Æ±ķŹ¾£©________mol/(L”¤s)”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com