
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
| 2ax |
| a-ax+2ax |
| 2ax |
| a-ax+2ax |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
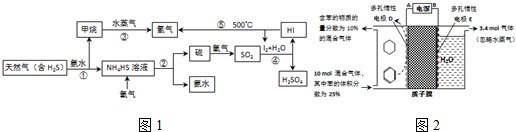
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl+2NH3?H2O→[Ag(NH3)2]Cl+2H2O |
| B、CuSO4+H2S→CuS↓+H2SO4 |
| C、KCl(l)+Na(l)→K↑+NaCl(l) |
| D、2[Ag(NH3)2]Cl+Na2S→Ag2S↓+2NaCl+4NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入适量的氯化铵晶体后,两溶液的pH均碱小 |
| B、温度下降10°C,两溶液的pH均不变 |
| C、分别加水稀释10倍,两溶液的pH仍相等 |
| D、用同浓度的盐酸中和,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com