
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | 只含X、Y、Z三种元素的化合物,一定是共价化合物 |
分析 Z是地壳中含量最高的元素,Z为O;由X的原子半径比Y的小,X与W同主族,短周期元素X、Y、Z、W 的原子序数依次增大,则X一定为第一周期元素,为H,W为Na;原子最外层电子数之和为13,则Y的最外层电子数为13-1-1-6=5,Y为第二周期的N元素,然后结合元素化合物性质及元素周期律来解答.
解答 解:A.电子层越多,半径越大,同周期原子序数大的原子半径小,则原子半径为r(W)>r(Y)>r(Z),故A错误;
B.元素Z(O)、W(Na)的简单离子的电子层结构相同,均有2个电子层,最外层电子数为8,故B正确;
C.非金属性Z>Y,则元素Y的简单气态氢化物的热稳定性比Z的弱,故C错误;
D.只含X、Y、Z三种元素的化合物,若为硝酸盐,则为离子化合物,若为硝酸,则是共价化合物,故D错误.
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构的关系推断各元素为解答的关键,注意元素周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 刚充入时反应速率υ正减少,υ逆增大 | |
| B. | 平衡向正反应方向移动 | |
| C. | 平衡向逆反应方向移动 | |
| D. | 物质C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
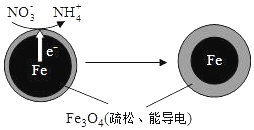 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 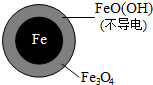 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHA其PH=1,溶液中存在:c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-) | |
| B. | 40%的醋酸溶液(p=1.049gcm-3)与60%的醋酸溶液(p=1.064gcm-3)等体积混合后,所得溶液中溶质的质量分数大于50% | |
| C. | 0.1mol/L的醋酸溶液V1L和等浓度的氢氧化钠溶液V2L混合后呈碱性,则一定有V1≤V2 | |
| D. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的电子式: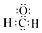 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: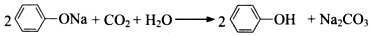 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com