
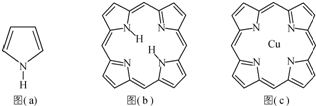
 ,
, ;
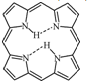
;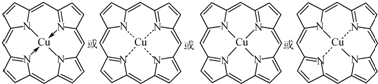 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、⑥⑦⑧⑨ | B、②④⑥⑧ |
| C、③④⑦⑧ | D、②④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
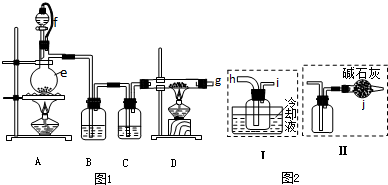
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
| 方案 | 不足之处 |
| 甲 | |
| 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
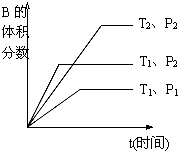 已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):
已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com