
【题目】下列关于如图所示各装置的叙述正确的是

A.装置①是原电池,总反应式是Cu+2Fe3+= Cu2++2Fe2+
B.装置①中,铁作正极,正极反应式为Fe3++e-= Fe2+
C.装置②可以减缓铁棒的腐蚀,此保护方法为牺牲阳极的阴极保护法
D.若用装置③精炼铜,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液
【答案】D
【解析】
A.根据装置①的图片可知该装置为原电池,铁的活泼性强于铜,因此铜为正极,电极反应为:Fe3++e-=Fe2+,铁为负极,电极反应为:Fe-2e-=Fe2+;
B.由选项A可知,铁为负极,失去电子,发生氧化反应;
C. 根据装置②的图片可知该装置为电解池,Zn与电源的正极相连,为阳极,Fe与电源的负极相连,为阴极;
D. 根据装置③的图片可知该装置为电解池,用该装置精炼铜时,粗铜作阳极,纯铜为阴极,电解质溶液为硫酸铜。
A.根据装置①的图片可知该装置为原电池,铜为正极,电极反应为:Fe3++e-=Fe2+,铁为负极,电极反应为:Fe-2e-=Fe2+,总反应式是Fe+2Fe3+=3Fe2+,A项错误;
B.该装置中铁为负极,失去电子,发生氧化反应,B项错误;
C. 根据装置②的图片可知该装置为电解池,Zn与电源的正极相连,为阳极,Fe与电源的负极相连,为阴极,该装置可以减缓铁棒的腐蚀,称为外加电流的阴极保护法,C项错误;
D. 根据装置③的图片可知该装置为电解池,由电流方向可知,a为正极、b为负极,c为阳极、d为阴极,用该装置精炼铜时,粗铜作阳极,纯铜为阴极,电解质溶液为硫酸铜,D项正确;
答案选D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是
A. 原子半径:c>d>a
B. d的氧化物对应的水化物酸性均比b的强
C. a、b、d三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种短周期元素,在元素周期表中,X的原子半径最小,Z的非金属性最强。又知,Y原子的最外层电子数比次外层电子数多4个,X、Y能形成甲、乙两种化合物,乙中X和Y的原子个数比为1:1。
(1)X、Y、Z的元素符号为:X _____Y ________Z_________;
(2)甲中存在的化学键类型为________________________;
(3)Z的原子结构示意图为___________________________;
(4)向甲和乙的混合物中加入少量MnO2,发生反应的化学方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某可逆反应aA(g) ![]() bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
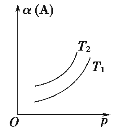
A.a>b+c
B.该反应的平衡常数随温度的升高而增大
C.T1﹤T2
D.该反应自发进行的温度是低温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是
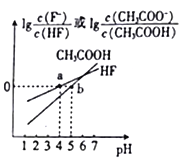
A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH小于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 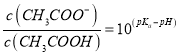
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )

A. 电池工作时,正极附近的pH降低
B. 当消耗1 mol O2时,有2 mol Na+由甲槽向乙槽迁移
C. 负极反应为4OH-+N2H4-4e-===N2↑+4H2O
D. 若去掉阳离子交换膜,电池也能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
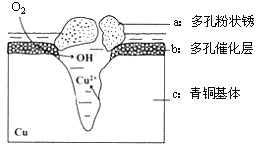
(1) 腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
(2) 环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 ;
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com