
| A. | 铈(Ce)元素在自然界中主要以化合态形式存在 | |
| B. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四种稳定的核素58136Ce、58138Ce、58140Ce、58142Ce,它们互称为同位素 |
分析 A、根据金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应分析;
B、铈离子具有氧化性,碘离子具有还原性,二者可以发生氧化还原反应;
C、根据氧化性是Ce4+>Fe3+,结合离子反应遵循电荷守恒来回答;
D、具有相同质子数,不同中子数的不同原子互为同位素.
解答 解:A、金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应,所以铈(Ce)元素在自然界中主要以化合物形式存在,故A正确;
B、金属铈可以和强酸HI酸反应生成盐和水,但是铈离子具有氧化性,碘离子具有还原性,二者可以继续发生氧化还原反应,故B错误;
C、氧化性是Ce4+>Fe3+,所以用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+,故C正确;
D、核素13658Ce、13858Ce、14058Ce、14258Ce,是具有相同质子数,不同中子数的不同原子,它们互称为同位素,故D正确;
故选B.
点评 本题考查了氧化还原反应、金属性质、同位素等知识,主要是考查分析、利用信息,信息迁移和解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol/L的溶液:Al3+、CH3COO-、NH4+、HCO3- | |
| B. | 试KSCN溶液变红的溶液:Na+、SO42-、H2O2、Cl- | |
| C. | 使酚酞变红的溶液:Ag(NH3)2+、CO32-、K+、S2- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液:K+、AlO2-、SiO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列物质的变化,不能通过一步化学反应完成的是
A.Cu→CuSO4 B.SiO2→H2SiO3 C.Cl2→HClO D.NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
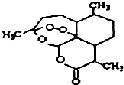 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青篙素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根据上表水解方程式ClO-+H2O?HClO+OH-的平衡常数K≈10-7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
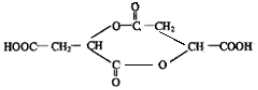 .
.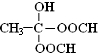 .(已知:
.(已知: )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
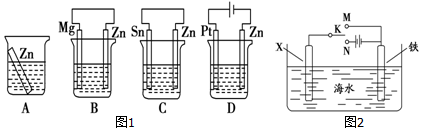
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com