
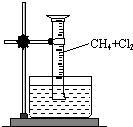
 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.分析 【实验一】甲烷与氯气在光照条件下发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,水槽中的液体必须满足:氯气在该溶液中溶解度很小,以便证明氯气与甲烷发生了反应,据此解答;
【实验二】(4)根据氯水的成分进行解答;
【实验三】(5)如果步骤二中没有生成HCl,那么pH也应该是3.26,.现在pH变小,说明生成的HCl溶于水导致pH变小;
解答 解:【实验一】(1)甲烷与氯气在光照条件下发生取代反应;
故答案为;取代反应;
(2)甲烷与氯气在光照条件下发生取代反应生成一氯甲烷和氯化氢,方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(3)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;由于氯气在水中溶解度较大、氯水能够与饱和石灰水、饱和碳酸氢钠溶液反应,干扰的实验结果,而不能使用水,更不能使用饱和石灰水、饱和碳酸氢钠溶液,
故答案为:C.
【实验二】(4)存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生Ag++Cl-=AgCl↓产生白色沉淀,故此结论是不正确的.
故答案为:不正确;氯水中加入AgNO3溶液也会产生白色沉淀;
【实验三】(4)步骤一:氯气溶于水后,Cl2+H2O?H++Cl-+HClO生成盐酸,其pH为3.26,步骤二:pH=1.00,比3.26小,说明除了氯气溶于水生成盐酸外还有别的反应产生HCl,故答案为:步骤二测得的pH值比步骤一测得的pH值低;
点评 本题考查了甲烷的取代反应实验探究,明确甲烷的化学性质及甲烷与氯气发生取代反应的原理,解题时注意物质检验方案设计必须满足严密性,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、K+、Cl-、S2- | D. | Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉露置在空气中:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用少量氨水吸收二氧化硫:SO2+NH3•H2O=HSO3-+NH4+ | |
| C. | 少量CO2通入苯酚钠溶液:2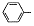 +CO2+H2O→2 +CO2+H2O→2 OH+CO32- OH+CO32- | |
| D. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E是一种非金属元素 | B. | 在ECln中E与Cl之间形成共价键 | ||
| C. | E的一种氧化物为EO | D. | E位于元素周期表的ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe元素的化合价升高 | B. | Al化合价升高 | ||
| C. | 该反应是化合反应 | D. | Al化合价没变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若t1>t2,则v1>v2 | |
| B. | 甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol C,则甲容器内的反应速率比乙容器内的反应速率快 | |
| C. | 当温度升高时v1增大,v2减小 | |
| D. | 在甲、乙容器中分别加入MnO2,v1、v2不一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向滴有酚酞的水中加入过量Na2O2粉末并振荡,溶液由无色变红又变无色 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 将一小粒金属钠投入水和苯的混合体系中,钠在苯与水的界面处反应并可能作上、下跳动 | |
| D. | 某物质灼烧时,焰色反应为黄色,该物质一定只含钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4的摩尔质量为32 | |
| B. | 1 molN2H4的质量为32 g•mol-1 | |
| C. | 在标准状况下,1 mol N2H4的体积约为22.4L | |
| D. | 6.02×1023个N2H4分子的质量为32g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com