
| A. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
分析 A.硫化钠与铜离子反应生成硫化铜沉淀;
B.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.氯水能够氧化亚硫酸根离子;
D.碳酸氢钠与氢离子反应.
解答 解:A.Na2S与Cu2+之间反应生成CuS沉淀,在溶液中不能大量共存,故A错误;
B.该溶液呈碱性,溶液中存在大量氢氧根离子,K+、AlO2-、CO32-、Na+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.氯水具有氧化性,能够氧化SO32-,在溶液中不能大量共存,故C错误;
D.H+与碳酸氢钠反应生成二氧化碳气体和水,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50s内B的平均反应速率v(B)=0.0032mol•L-1•s-1 | |
| B. | 相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,则达到平衡前 v(正)>V(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2mol.L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶于水中:CO32-+2H2O?H2CO3+2OH- | |
| B. | 硫酸氢铵与少量氢氧化钠溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化铝溶液中滴入过量浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 酸性高锰酸钾溶液与草酸溶液混合:5H2C2O4+6H++2MnO4-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
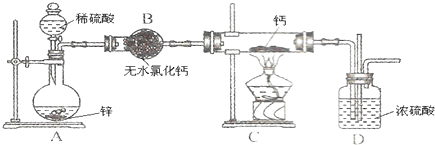
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
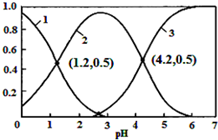 已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3) | |
| B. | 常温下,$\frac{{c}^{2}(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})•c(S{{O}_{3}}^{2-})}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小 | |
| D. | 曲线3表示的微粒是SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ②④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com