
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H=-38.19 kJ·mol-1
则表示 CH3OH 的燃烧热的热化学方程式为___________ 。
(2)在一定条件下用CO和H2合成 CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。
CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。

回答下列问题:
①该反应的反应热 Δ H________ 0(填“>” 或“<” ),压强的相对大小与p1_______ p2(填“>” 或“<” )。
②压强为 p2,温度为 300℃时,该反应的化学平衡常数的计算式为K=_______(只列算式不计算结果)。
③下列各项中,不能说明该反应已经达到平衡的是_______。
A.容器内气体压强不再变化
B.υ (CO):υ (H2)=1:2
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, 平衡_______。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
【答案】 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) Δ H=-726.51 kJ·mol-1 < > ![]() BC C
BC C
【解析】(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H1=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H2=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H3=-38.19 kJ·mol-1
根据盖斯定律,由②×3- ①×2-③得反应CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) Δ H=Δ H2×3-Δ H1×2-Δ H3=-726.51 kJ·mol-1;(2)①随着温度升高,甲醇的体积分数减少,根据勒夏特列原理,升高温度,平衡向吸热反应的逆方向移动,即正反应为放热反应,Δ H<0;作等温线,随着压强增大,平衡向体积减小的正方向移动,根据图表可知p1>p2;②压强为 p2,温度为 300℃时,CH3OH的体积分数为50%,设CO的转化率为x则CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.5 1 0
改变浓度(mol/L) 0.5x x 0.5x
平衡浓度(mol/L) 0.5-0.5x 1-x 0.5x
CH3OH的体积分数为![]() ×100%=50%,解得x=0.75,该反应的化学平衡常数的计算式为K=
×100%=50%,解得x=0.75,该反应的化学平衡常数的计算式为K=![]() =
=![]() ;③A、反应前后气体系数之和不相等, 则压强不变,说明反应达到平衡,选项A不选;B、没有指明反应的方向,不能说明正逆反应速率相等,则不能证明达到平衡状态,选项B选;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,选项C选;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不相等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡状态,选项D不选;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,选项E不选。答案选BC;④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=
;③A、反应前后气体系数之和不相等, 则压强不变,说明反应达到平衡,选项A不选;B、没有指明反应的方向,不能说明正逆反应速率相等,则不能证明达到平衡状态,选项B选;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,选项C选;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不相等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡状态,选项D不选;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,选项E不选。答案选BC;④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=![]() ,推得 Qc=K,所以平衡不移动,答案选C。
,推得 Qc=K,所以平衡不移动,答案选C。


科目:高中化学 来源: 题型:
【题目】写出下列有机反应的化学方程式
(1)由苯乙烯 ![]() 制取 聚苯乙烯
制取 聚苯乙烯
(2)丙烯与溴化氢按照马氏规则发生加成反应
(3)甲苯与氯气在光照的条件下发生取代反应(仅写一元取代)
(4)乙烯使溴水褪色 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)
D.0.1molL﹣1的硫化钠溶液中,c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: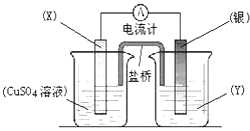
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;
(3)外电路中的电子是从电极流向电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
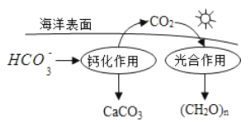
【题目】研究 CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3-占 95%,写出 CO2溶于水产生 HCO3-的方程式: ___________、___________。
(2)在海洋循环中,通过如图所示的途径固碳, 写出钙化作用的离子方程式__________。
(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:①气提、吸收 CO2 。用 N2 从 H2SO4溶液酸化后的 Z mL海水中吹出 CO2 并用碱液吸收(装置如图)
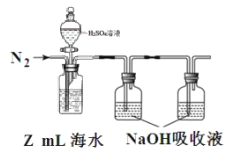
②滴定。将吸收液吸收的无机碳转化为 NaHCO3,再用x mol/L盐酸滴定,消耗y mL盐酸,则海水中溶解无机碳的浓度=________mol/L。
(4)利用下图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。
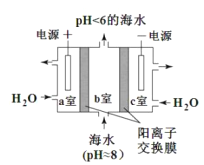
①提取CO2 的原理:_____(填 a 或 b)室产生的 H+ 通过阳离子膜进入b 室,发生反应:。 ________。
②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的具体方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先未烘干
B.定容时俯视观察液面
C.未用蒸馏水洗涤烧杯
D.定容后,摇匀时有少量液体流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com