
| A. | 干水是纯净物 | B. | 干水和干冰是同一种物质 | ||
| C. | 干水中的水分子不再运动 | D. | 用干水能更好地吸收CO2 |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
根据表,下列说法正确的是()
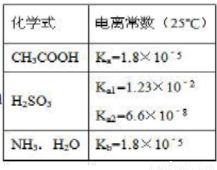
A.25°C时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的
B.Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO3 +2CH3COOH=SO2↑+H2O+2CH3COO-
C. NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2
D.0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa 混合后,溶液中的微粒存在以下关系: c (H+) +c (CH3C OOH) =c (CH3COO-
OOH) =c (CH3COO- ) +2c (OH-)
) +2c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z=2 | B. | 2s后,容器内的压强是初始的$\frac{7}{8}$倍 | ||
| C. | 2s时C的体积分数为$\frac{2}{7}$ | D. | 2s后,B的浓度为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Na2Sx是氧化剂,NaClO是还原剂 | |
| B. | Na2Sx含有离子键和极性共价键 | |
| C. | 1molNa2Sx参加反应,有32mol电子转移 | |
| D. | Na2Sx中的X数值为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 通入CH4的电极反应为:CH4+10OH-→CO32-+7H2O+8e- | |
| C. | 通入O2的电极为负极 | |
| D. | 放电时溶液中阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某HCl溶液的pH值为2,则溶液中由水电离的c(H+)=10-2mol•L-1 | |
| B. | 0.1 mol•L-1的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) | |
| C. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后溶液pH>7,则反应后的混合液:c(HA)>C(Na+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 1 mol Na2O2与足量H2O反应,转移的电子数为NA | |
| C. | 物质的量浓度为0.5 mol/L MgCl2溶液,含有Cl-离子数为NA | |
| D. | 2.7g铝与足量的盐酸或氢氧化钠溶液反应,生成H2的分子数均为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com