
| A�� | �ö��Ե缫���MgCl2��Һ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$ Cl2��+H2��+2OH- | |
| B�� | ��ʯ��ˮ�еμ�����Ca��HCO3��2��Һ��Ca2++2HCO3-+2OH-=CaCO3��+CO32-+2H2O | |
| C�� | ����������ˮ��Ӧ��2O22-+2H2O=4OH-+O2�� | |
| D�� | һ����������Һ�еμ�Ba��OH��2��Һ���������������ʱ��2Ba2++4OH-+Al3++2SO42-=2BaSO4��+AlO2-+2H2O |
���� A������������þ��������������
B����Ӧ����̼��ƺ�ˮ��
C���������������ӷ�Ӧ�б�����ѧʽ��
D������������������������ᱵ��ƫ����ء�ˮ��
��� �⣺A���ö��Ե缫���MgCl2��Һ�����ӷ�ӦΪMg2++2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$ Cl2��+H2��+Mg��OH��2������A����
B����ʯ��ˮ�еμ�����Ca��HCO3��2��Һ�����ӷ�ӦΪCa2++HCO3-+OH-=CaCO3��+H2O����B����
C������������ˮ��Ӧ�����ӷ�ӦΪ2Na2O2+2H2O=4Na++4OH-+O2������C����
D��һ����������Һ�еμ�Ba��OH��2��Һ���������������ʱ�����ӷ�ӦΪ2Ba2++4OH-+Al3++2SO42-=2BaSO4��+AlO2-+2H2O����D��ȷ��
��ѡD��
���� ���⿼�����ӷ�Ӧ����ʽ��д�������жϣ�Ϊ��Ƶ���㣬���շ����ķ�Ӧ�����ӷ�Ӧ����д����Ϊ���Ĺؼ�������������ԭ��Ӧ�������йص����ӷ�Ӧ���飬ѡ��BDΪ�����ѵ㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
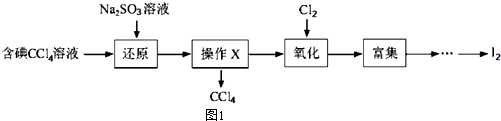
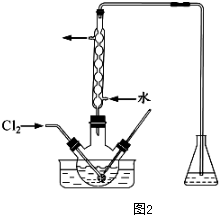
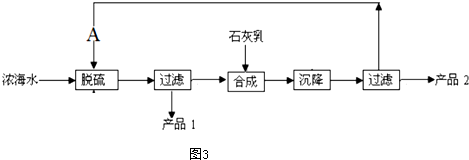
| ���� | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| Ũ��/��g��l-2�� | 63.7 | 28.8 | 144.6 | 46.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| H2O | C | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H1����H2����H3 | B�� | ��H2����H3��2��H1 | C�� | ��H2����H1����H3 | D�� | ��H3����H2��2��H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A�� | ����ӦΪ���ȷ�Ӧ | |
| B�� | ʵ��1�У�CO��ת����Ϊ80% | |
| C�� | 650��ʱ����ѧƽ�ⳣ��K=$\frac{8}{3}$ | |
| D�� | ʵ��1�ټ���1.0 mol H2O�����´ﵽƽ��ʱ��n��CO2��Ϊ1.6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
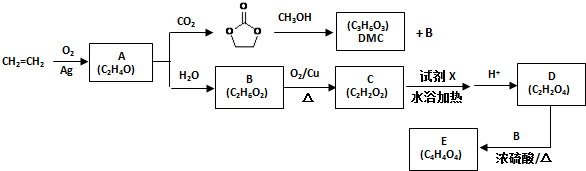
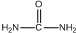 ���ͼ״��ڴ��������������£�����ȡ����Ӧ����DMC����д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ
���ͼ״��ڴ��������������£�����ȡ����Ӧ����DMC����д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ +2CH3OH$��_{��}^{����}$CH3OCOOCH3+2NH3����
+2CH3OH$��_{��}^{����}$CH3OCOOCH3+2NH3�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ɷ� | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| ����/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
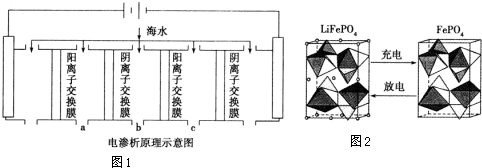
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol/L BaCl2��Һ�к��еı�������ΪNA | |
| B�� | 1 molþԭ���к��еĵ�����Ϊ2NA | |
| C�� | ���³�ѹ�£�11.2 L H2�к��е��������Ϊ0.5NA | |
| D�� | 16 g O3�к��е���ԭ����ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com