
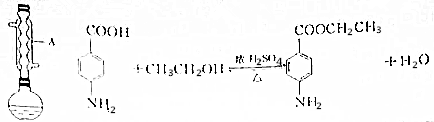
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
分析 (1)由仪器的结构特征,可知a为球形冷凝管;
(2)液体加热,需要防止暴沸;
(3)加入过量乙醇,有利于平衡正向移动,可以提高对氨基苯甲酸的利用率;
(4)反应后有未反应的对氨基苯甲酸,需要除去;
(5)分液漏斗使用前必须进行查漏,分液时,下层液从分液漏斗下口放出,上层液从上口倒出;
(6)硫酸镁吸收乙醚中的水;
(7)根据氨基苯甲酸计算苯佐卡因的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)由仪器的结构特征,可知a为球形冷凝管,
故答案为:球形冷凝管;
(2)碎瓷片的作用是防止暴沸,
故答案为:防止暴沸;
(3)加入过量乙醇,有利于平衡正向移动,可以提高对氨基苯甲酸的利用率,
故答案为:提高对氨基苯甲酸的利用率;
(4)反应后有未反应的对氨基苯甲酸,加入NaHCO3溶液的作用是:除去混有对氨基苯甲酸,
故答案为:除去混有对氨基苯甲酸;
(5)分液漏斗使用前必须进行查漏,分液时,先将下层液从分液漏斗下口放出,再将上层液从上口倒出,
故答案为:查漏;下层液从分液漏斗下口放出;上层液从上口倒出;
(6)加入少量无水硫酸镁的目的是:吸收乙醚中的水,
故答案为:吸收乙醚中的水;
(7)苯佐卡因的理论产量为0.003mol×165g/mol=0.495g,故产率=$\frac{0.198g}{0.495g}$×100%=40.0%,
故答案为:40%.
点评 本题考查有机物的制备实验,涉及化学仪器识别与使用、物质的分离提纯、基本操作、产率计算等,是对制备实验的综合考查,难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
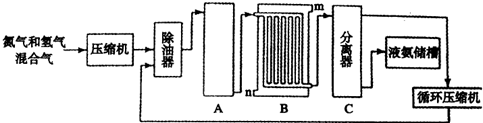
 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J•t-1 | 28109 | 38109 | 48109 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①变轻,②变重,③不变 | B. | ①变轻,②不变,③变重 | ||
| C. | ①变轻,②不变,③不变 | D. | ①变重,②不变,③变轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com