
| A. | Al3+ | B. | Fe3+ | C. | Cl- | D. | Fe2+ | ||||
| E. | Na+ |
分析 NaOH与Fe3+、Fe2+和Al3+等离子分别反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,氢氧化亚铁易被氧化为氢氧化铁,再加入过量的稀盐酸,只发生氢氧化铝、氢氧化铁与盐酸的反应,以此来解答.
解答 解:混合溶液中加入足量NaOH微热,生成Fe(OH)3、Fe(OH)2沉淀和NaAlO2,Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,
再向混合物中加入过量盐酸,则Fe(OH)3和NaAlO2与过量酸作用分别生成AlCl3、FeCl3,
则减少的离子主要有Fe2+,增大的为Fe3+,
加NaOH使Na+增大,加盐酸使增大Cl-,离子基本不变的为Al3+,
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液和pH=10的KOH溶液等体积混合:2c(K+)+c(H+)=c(OH-)+c(CH3COOH)+2c(CH3COO-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3至溶液pH=7 (体积变化可忽略):c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 0.3mol的SO2通入1L0.4mol/L的NaOH溶液中:4c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3) | |
| D. | 0.1mol/L的HF溶液和0.1mol/L的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(H+)+c(F-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | NaH2PO4═Na++H2PO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰石溶于盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化钠溶液与稀硝酸反应:H++OH-═H2O | |
| D. | 铜和稀盐酸反应:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验 | 制取蒸馏水 | 制取NH3 | 收集NO2 | 分离水和酒精 |
| 装置 或 仪器 | 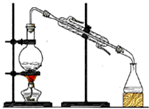 |  |  | 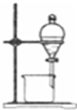 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用蒸馏可以除去水等液体中难挥发或不挥发的杂质 | |
| B. | 酒精是一种常用萃取剂,若用来萃取溴水中的溴,由于密度小静置后在上层 | |
| C. | 混有少量氯化钾的硝酸钾,可以利用过滤的方法得到纯净的硝酸钾晶体 | |
| D. | 用分液漏斗将溴水中的下层液溴放出的方法为分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com