
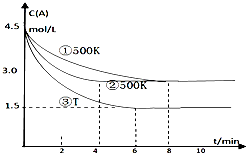
 某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.| △c |
| △t |
| △c |
| △t |
| 3mol/L |
| 6min |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将0.1mol氨气充分溶解在1L水中 |
| B、将10g质量分数为98%的硫酸与990g水混合 |
| C、将8g三氧化硫溶于水并配成1L溶液 |
| D、将0.1mol氧化钾溶于水并配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| C、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、NaOH溶液中通入过量SO2:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Q | R | ||
| T | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com