
| A. | 氯原子的结构示意图: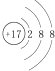 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
分析 A.氯原子的核电荷数=核外电子总数=17,最外层为7个电子;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氯化镁为离子化合物,阴阳离子需要标出所带电荷,阴离子还需要标出最外层电子;
D.氯化氢为共价化合物,不存在阴阳离子,电子式中不能标出电荷.
解答 解:A.氯原子的核电荷数、核外电子总数都是17,最外层只有7个电子,氯原子正确的结构示意图为: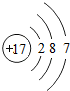 ,故A错误;
,故A错误;
B.6个质子8个中子的碳原子的质量数为14,该碳元素的核素符号为:614C,故B错误;
C.氯化镁为离子化合物,氯化镁的电子式为: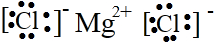 ,故C正确;
,故C正确;
D.氯化氢属于共价化合物,用电子式表示其形成过程为: ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确原子结构示意图与离子结构示意图、离子化合物与共价化合物的电子式的区别,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表含元素最多的族是第ⅢB族 | |
| B. | 元素周期表有18个族 | |
| C. | 第ⅠA族的元素全部是金属元素 | |
| D. | 长周期是指第四、五、六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2═CHCH3 | B. | CH3CH═CHCH3 | C. | (CH3)2C═C(CH3)2 | D. | CH3CH2CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
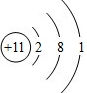 .
. .
. 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
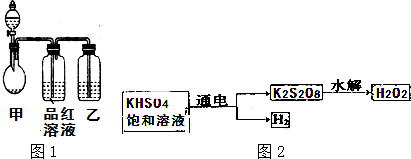
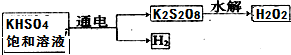
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢氧化铁胶粒的分散系中可能大量存在H+,K+,S2-Br- | |
| B. | 高锰酸钾溶液中可能大量存在H+,Na+,SO42-,葡萄糖分子 | |
| C. | 弱碱性溶液中可能大存在Na+,K+,Cl-,HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+,K+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com