
分析 (1)P原子有三个能层;最外层为3s2p3,p轨道的电子云在三维空间中有3个延伸方向,原子轨道为哑铃形;
(2)同一周期元素自左而右第一电离能呈增大趋势,但P元素原子3p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)PCl3中P、Cl均满足8电子稳定结构,计算中P的价层电子对数,然后判断;
(4)先根据直角三角形计算正四面体的边长,确定晶胞的边长,再根据ρ=$\frac{m}{V}$计算密度;
(5)根据构造原理写出基态铁原子核外电子排布式;H3[Fe(PO4)3]中PO43-为配体,Fe3+为中心离子;
(6)由链状结构可知每个P与3个O形成阴离子,且P的化合价为+5价,以此判断形成的化合物的化学式.
解答 解:(1)P原子核外有15个电子,分三层排布,即有三个能层,所以电子占据的最高能层符号为M;最外层为3s2p3,p轨道的电子云在三维空间中沿着x、y、z轴3个方向延伸,p原子轨道为哑铃形;
故答案为:M;3;哑铃;
(2)C、N、O元素是同一周期相邻元素,同一周期元素自左而右第一电离能呈增大趋势,但P元素原子3p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S>Si,
故答案为:P>S>Si;
(3)单质磷与Cl2反应,可以生成PCl3和PCl5,PCl3中P、Cl均满足8电子稳定结构,PCl3中P原子的价层电子对数为3+$\frac{1}{2}$(5-1×3)=4,P原子的杂化轨道类型为sp3,所以分子的空间构型为三角锥型;
故答案为:sp3;三角锥型;
(4)AB、AC、AD、BC、BD、CD的边长相等,AF、BF的长相等为a,F位于体心上,O位于正三角形BCD的重心上,在正三角形BCD中,BE为三角形BCD的高,则CE为BC的一半,如图 ,
,
设正四面体的边长为x,CE的长为0.5x,BE=$\sqrt{{x}^{2}-(0.5x)^{2}}$=$\frac{\sqrt{3}}{2}$x,BO与OE的长之比为2:1,则BO的长为=$\frac{\sqrt{3}}{2}x$×$\frac{2}{3}$=$\frac{\sqrt{3}x}{3}$x,在三角形ABO中,AO的长=$\sqrt{{x}^{2}-(\frac{\sqrt{3}}{3}x)^{2}}$=$\frac{\sqrt{6}}{3}x$,在三角形BFO中,OF的长=$\frac{\sqrt{6}}{3}x$-a=$\sqrt{{a}^{2}-(\frac{\sqrt{3}}{3}{x)}^{2}}$,x=$\frac{2}{3}$$\sqrt{6}a$,因正四面体的边长为x,对角线长2x,晶胞的棱长为2x×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$x=$\frac{4}{3}$$\sqrt{3}a$,
一个晶胞中含有P原子:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,B原子在内部,共4个,即一个晶胞中含有4个BP,密度的表达式ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(\frac{4}{3}\sqrt{3}a)^{3}}$=$\frac{3\sqrt{3}M}{16{N}_{A}{a}^{3}}$;
故答案为:$\frac{3\sqrt{3}M}{16{N}_{A}{a}^{3}}$;
(5)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为1s22s22p63s23p63d64s2,则基态Fe3+的核外电子排布式为1s22s22p63s23p63d5;H3[Fe(PO4)3]中PO43-为配体,Fe3+为中心离子,中心离子提供空轨道,配体提供孤对电子;
故答案为:1s22s22p63s23p63d5;PO43-;孤对电子;
(6)由链状结构可知每个P与3个O形成阴离子,且P的化合价为+5价,则形成的化合物化学式为NaPO3,故答案为:NaPO3.
点评 本题考查物质结构和性质,涉及第一电离能的比较、杂化方式的判断、晶胞的计算、电子排布式、配合物等,侧重于基础知识的综合应用的考查,题目难度较大,注意把握晶胞的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | H2A在水溶液中的电离方程式为H2A=2H++A2- | |
| B. | 该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 | |
| C. | 体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A | |
| D. | 将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
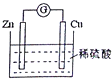
| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液刻制铜材电路板 | |
| B. | 用乙醇作萃取剂从碘水中提取碘 | |
| C. | 在常温下用铝制容器贮运浓硫酸 | |
| D. | 向含硫高的煤中加入生石灰,可减少燃料对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:H2S在高温下分解生成硫蒸气和H2.现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示,则生成的硫蒸气化学式为( )
已知:H2S在高温下分解生成硫蒸气和H2.现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示,则生成的硫蒸气化学式为( )| A. | S | B. | S2 | C. | S6 | D. | S8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:24:37 | C. | 23:12:9 | D. | 36:69:92 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com