
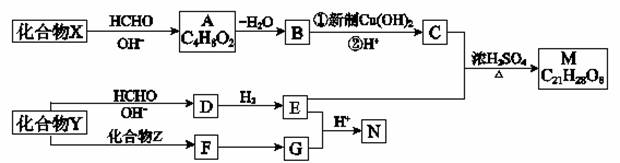
重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示:
[:
已知:
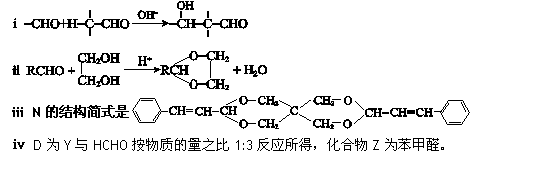

请回答下列问题:
(1)A中含氧官能团名称是 ;由A生成B的反应类型是 。
(2)X的结构简式为 。
(3)C和F在一定条件下可反应生成一种有香味的物质。写出该反应的化学方程式 。
(4)下列说法正确的是 。
a.E能发生消去反应 b.1 molM中含有4 mol酯基 c.X与Y互为同系物
(5)写出由Y生成D的化学方程式 。
(6)写出同时满足下列三个条件的F的同分异构体的结构简式 。
a.与F官能团种类和数目都相同 b.苯环上只有一个侧链
c.核磁共振H谱图中出现6或7个峰
科目:高中化学 来源: 题型:
某合作学习小组的同学利用下列氧化还原反应设计原电池:
2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
 A.乙烧杯中发生还原反应
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO 移向甲烧杯
移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A. 向CuSO4溶液中加入钠:Na + Cu2+ = Cu + Na+
B. 向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2
C. 澄清石灰水与盐酸反应:H+ + OH- = H2O
D. 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe +3Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
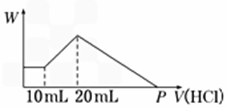
(1)混合物中NaOH的质量为_________g,混合物中AlCl3的质量为___________g,混合物中MgCl2的质量为_____________g.
(2)P点表示盐酸的体积是____________mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
据下表信息,判断以下叙述正确的是( )
A.GOH溶液和M(OH)3可以相互反应
B.非金属性:T<Q
C.气态氢化物的稳定性:R>T
D.L2+与T2-核外电子数相等
| 部分短周期元素的原子半径及主要化合价 | ||||||
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质之间的反应中,水既不是氧化剂又不是还原剂的是
A.F2 + H2O (生成F2和HF) B.Na + H2O
C.NaH + H2O(生成H2和NaOH) D.Na2O2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A.B.C.D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
回答下列问题:
⑴ A、B、C、D各是什么物质,写出它们的化学式为:
A 、B 、C 、D 。
⑵ 现象②中所发生的反应的化学方程式为:
;
。
⑶ 现象③中所发生反应的离子方程式为:
;
。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究
甲醇具有重要意义。
 (1)用CO合成甲醇的反应为:CO(g)+2H2(g)
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH (g)
CH3OH (g)
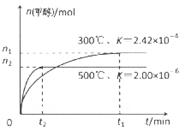
在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验 测得甲醇的物质的量和温度、时间的关系曲线如右图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
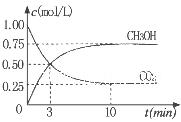 ②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。
和CH3OH(g)的浓度随时间变化如右图所示。从反应开始到
平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。
能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
 ①甲醇蒸汽重整法。主要反应为;CH3OH(g)
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
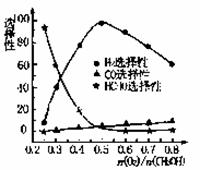
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催
化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如右图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com