
 .
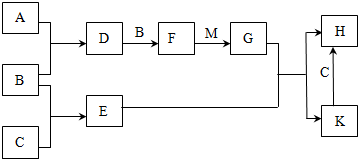
.分析 A为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知B为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,结合对应物质的性质以及题目要求可解答该题.
解答 解:A为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知B为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,
(1)分析可知K为Fe3(SO4)2,
故答案为:Fe3(SO4)2;
(2)M为H2O,为共价化合物,电子式为 ,
,
故答案为: ;
;
(2)D为SO2,具有还原性,可与酸性高锰酸钾发生氧化还原反应而是高锰酸钾溶液褪色,
故答案为:B;
(3)铁和水蒸气在高温发生反应生成Fe3O4和H2,反应的方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(4)D为二氧化硫与氯化钡不反应,通入氨气,溶液呈碱性,存在大量的亚硫酸根离子,可生成亚硫酸钡沉淀,
故答案为:先无明显现象,通入NH3后产生白色沉淀;
(5)H为FeSO4,具有还原性,可与空气中氧气发生反应生成红褐色氢氧化铁沉淀,反应的离子方程式为12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+,
故答案为:12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+;
(6)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,A为S,C为Fe,物质的量之比=$\frac{7}{56}$:$\frac{4}{32}$=1:1,化合物为FeS,用于生产G为H2SO4.某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,依据反应过程中 硫元素守恒,设可制得含G 98%的产品质量为xt,
FeS~H2SO4,
88 98
8.8t×(1-25%) 98%x
x=7.5t,
故答案为:7.5;
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合可根据物质的特殊颜色或特殊化学反应,推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | HC1溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com