
【题目】材料与化学密切相关,表中对应系错误的是w.w.w.k.s.5.u.c.o.m
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
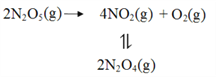
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1 ,2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1,则反应N2O5(g)=2NO2(g)+1/2O2(g)的ΔH =_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率v=2×10-3×P(N2O5)(KPa/min)。t=62 min时,测得体系中P(O2)=2.9 kPa,则此时的P(N2O5)=________ kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”)。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A、B同主族,C、D同周期,B、E同周期。气体A2与气体C2混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B、C、E简单离子的核外电子排布相同。E的最高价氧化物可与B的最高价氧化物的水化物反应生成一种易溶于水的的盐,D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B两种元素的元素名称:A________、B________写出D的最高价氧化物的电子式___________。
(2)写出由B和C两元素形成的原子个数比为1:1的化合物F存在的化学键是_______________________
(3)写出F和A2C反应的离子方程式:________________________________。
(4)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:

①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯和乙烯的叙述中正确的是( )
A.两者都容易发生取代反应
B.两者都可以与溴水发生加成反应
C.两者分子中所有原子都在同一平面内
D.两者都含有碳碳双键,能与酸性KMnO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图![]() X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y+Z↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是

A. 该装置能够将电能转化为化学能
B. 管道右端腐蚀比左端快,右端电极反应式为Fe-2e-![]() Fe2+
Fe2+
C. 如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D. 钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如下图所示。下列有关说法不正确的是( )
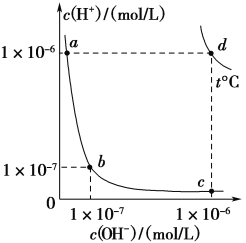
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. 温度为t ℃时,0.05 mol/L Ba(OH)2溶液的pH=11
D. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO![]() 、K+、Cl-、Na+
、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO![]() 、Mg2+、Na+、SO
、Mg2+、Na+、SO![]()
C. 在![]() =1×1012的溶液中:NH
=1×1012的溶液中:NH![]() 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO![]()
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO
=10-14mol·L-1的溶液中:Na+、HCO![]() 、Cl-、K+
、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿。软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol·L﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图所示。请回答下列问题:
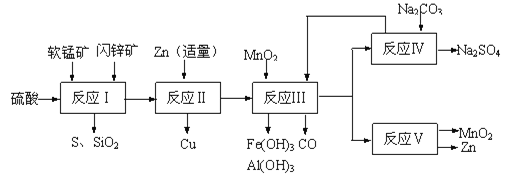
(2)反应Ⅰ后过滤所得滤液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子。试写出反应Ⅰ中生成CuSO4的化学方程式____________。
(3)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式为_________。
(4)反应Ⅲ中加入MnO2的作用是(离子方程式表示)______________________。
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为__________。
(6)图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com