
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0

①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
【答案】 Q3 = Q1-Q2 吸热 T3>T2>T1 m1>m2>m3 C2H5OH 0.250
【解析】试题分析:(1)根据盖斯定律计算Q3;K1=![]() ,K2=
,K2=![]() ;K3=
;K3=![]() ,分别计算973K、1173K时K3的平衡常数,根据平衡常数变化判断吸放热;(2)①正反应放热,温度越高CO2的平衡转化率越小;增大n(H2),平衡正向移动,CO2的平衡转化率越大;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的
,分别计算973K、1173K时K3的平衡常数,根据平衡常数变化判断吸放热;(2)①正反应放热,温度越高CO2的平衡转化率越小;增大n(H2),平衡正向移动,CO2的平衡转化率越大;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的![]() 倍;根据K=
倍;根据K= 计算;
计算;
解析:(1)①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H=Q1;
FeO(s)+CO(g) △H=Q1;
②Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H=Q2;根据盖斯定律①-②得H2(g)+CO2(g)
FeO(s)+H2(g) △H=Q2;根据盖斯定律①-②得H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=Q3= Q1-Q2;K1=
CO(g)+H2O(g) △H=Q3= Q1-Q2;K1=![]() ,K2=
,K2=![]() ;K3=
;K3=![]() ,所以973K时K3=0.62、1173K时K3=1.29,升高温度平衡常数增大,所以正反应吸热;(2)①正反应放热,温度越高CO2的平衡转化率越小,所以温度从高到低的顺序为T3>T2>T1;增大n(H2),平衡正向移动,CO2的平衡转化率越大,所以m1、m2、m3从大到小的顺序为m1>m2>m3;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的
,所以973K时K3=0.62、1173K时K3=1.29,升高温度平衡常数增大,所以正反应吸热;(2)①正反应放热,温度越高CO2的平衡转化率越小,所以温度从高到低的顺序为T3>T2>T1;增大n(H2),平衡正向移动,CO2的平衡转化率越大,所以m1、m2、m3从大到小的顺序为m1>m2>m3;②升高温度平衡逆向移动,CO2、H2含量增大、C2H5OH、H2O减小,乙醇的含量是水蒸气的![]() 倍,所以曲线d代表的物质为C2H5OH;Kp
倍,所以曲线d代表的物质为C2H5OH;Kp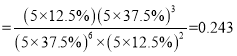 ;
;


科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。
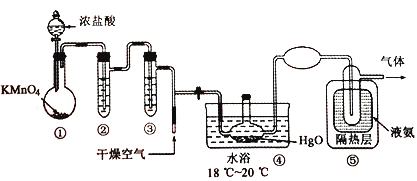
已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断正确的是
A. 碱性:Ca(OH)2 >Mg(OH)2 B. 酸性:H2SO3 > H2CO3
C. 热稳定性:NH3 < PH3 D. 还原性:S2- < F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2会形成酸雨,危害环境。某化学实验小组用如下装置进行有关SO2性质的探究活动。
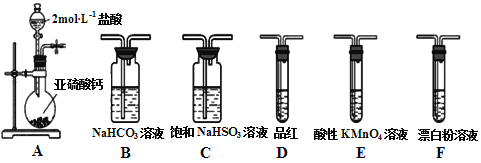
(1)装置A中反应的离子方程式为___________________________________。
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明,乙同学认为该方案不合理,其理由是___________________。正确的连接顺序是:A→C→___________→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是__________________________。
(3)将二氧化硫通入以下装置可以制备Na2S2O3:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是________________。
②写出装置A中发生反应的化学方程式___________________________________。
③Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=____mol·L-1。(已知:IO3-+5I-+6H+= 3I2+3H2O, 2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全反应生成氮气和水过程中的能量变化图。请回答下列问题:
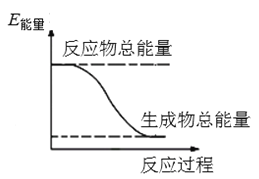
(1)肼又名联氨,请推测它的结构式:__________________________。
(2)液态肼与过氧化氢的反应属于________(填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____________________。
(4)已知肼和氧气可发生如下反应:N2H4(g)+O2(g)N2(g)+2H2O(g)
①某温度下,容积固定的密闭容器中,下列描述可说明上述反应达到平衡的是______。
A. υ(N2) = υ(N2H4)
B. c(N2H4) : c(O2) : c(N2) = 1:1:1
C. 混合气体的密度不再发生变化
D. 体系的压强不再发生变化
E. 混合气体的平均相对分子质量不再发生变化
F. 每断开1 mol O=O键,同时断开4 mol H-O键
②若想要增加该反应的正反应速率,你认为一定可行的方法有:____________。
A. 升高反应温度 B. 加入适当的催化剂
C. 向容器中加入氧气 D. 向容器中加入氖气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-==CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com