
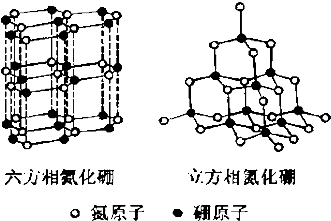
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.

 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 变化量 |
| 起始量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe[Ar]3d54s3 |
| B、F-1s22s22p5 |
| C、k[Ar]3d1 |
| D、p 1s22s22p63s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H6和C4H6O2 |
| B、C2H4和C2H6O |
| C、C2H2和C6H6 |
| D、CH4O和C3H4O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com