
A、 浓硫酸稀释 |
B、 除去CO2中混有的杂质气体(HCl) |
C、 分离出AgNO3溶液中的AgCl |
D、 称量32.6g的NaOH固体 |


科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 是重要的化工原料,其合成过程如下:
是重要的化工原料,其合成过程如下: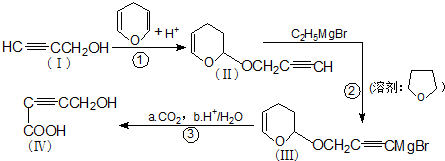
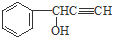 )与
)与 发生反应的方程式为
发生反应的方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
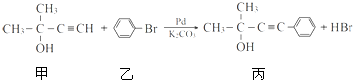
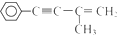 的反应条件是
的反应条件是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
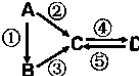 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com