
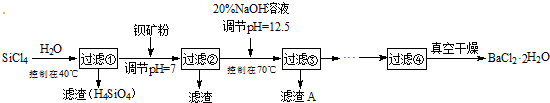
分析 控制温度40°C,四氯化硅发生水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有钙、铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁、氢氧化钙沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
根据盖斯定律,①+②可得:SiCl4(s)+2H2(g)=Si(s)+4HCl(g);
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;
(3)滤渣A的主要成分是氢氧化镁、氢氧化钙;温度越高,Ca(OH)2溶解度越小;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒.
解答 解:控制温度40°C,四氯化硅发生水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有钙、铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁、氢氧化钙沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
(1)已知:①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ•mol-1
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ•mol-1
根据盖斯定律,①+②可得:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ•mol-1;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)滤渣A的主要成分是Mg(OH)2、Ca(OH)2;温度越高,Ca(OH)2溶解度越小,控制温度70℃让钙离子沉淀完全,
故答案为:Mg(OH)2、Ca(OH)2;让钙离子沉淀完全;
(4)蒸发浓缩用到的含硅酸盐的仪器有:蒸发皿、酒精灯、玻璃棒,
故答案为:3.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对操作与条件控制分析、热化学方程式书写等,关键是对工艺流程的理解,是对化学实验的综合考查,充分考查了学生的分析理解能力及知识迁移运用的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
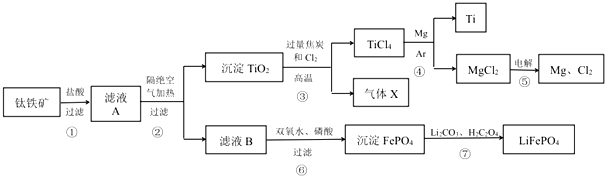
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
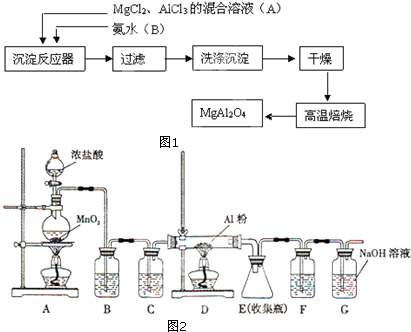
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将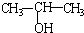 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸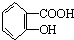 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂质量不变 | B. | 溶质质量变大 | C. | 溶液的浓度不变 | D. | 溶解度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入二氧化碳,溶液变浑浊 | 饱和碳酸钠溶液 |
| B | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失 | 硅酸钠溶液 |
| C | 通入二氧化碳,溶液变浑浊,继续通二氧化碳至过量,浑浊消失,再加入足量氢氧化钠溶液,又变浑浊 | 澄清石灰水 |
| D | 通入二氧化碳,溶液变浑浊,再加入品红溶液,红色褪色 | 次氯酸钙溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com