
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
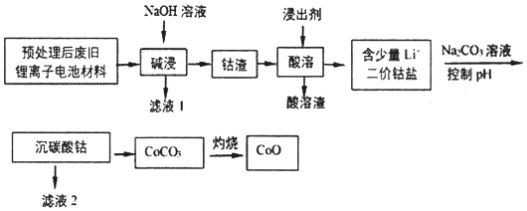
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
【答案】第四周期第VIII族 放电有利于Li+向正极移动并进入正极材料 粉碎、适当增大NaOH溶液的浓度(或适当升高温度等) 有Cl2生成,污染空气 (c) Co3O4能氧化Cl-,生成有污染性的氯气,而Na2S2O3在溶液中受热影响小,因此选择(c)效果优于前者 Na2S2O3 4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O 8.0
【解析】
(1)Co原子序数是27,根据原子结构推断其在周期表的位置;
(2)原电池放电时,阳离子由负极移向正极,提高浸取率的措施有固体粉碎、玻璃棒搅拌、适当升高浸取液的温度和增大浸取液的浓度、延长浸取时间等;
(3)废料用碱液溶解,过滤得到滤液①偏铝酸钠溶液和钴渣;用H2SO4、Na2S2O3溶解钴渣,发生的反应为4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液将钴离子转化成碳酸钴沉淀,过滤得到碳酸钴沉淀,灼烧碳酸钴得到氧化钴,据此分析解答;
(4)先求出c(Co2+),再根据KspCo(OH)2=c(Co2+)×c2(OH-)=1.0×10-15进行计算。
(1)Co原子序数是27,核外电子排布式为[Ar]3d74s2,位于第四周期第VIII族,故答案为:第四周期第VIII族;
(2)原电池放电时,电解质溶液中阳离子由负极移向正极,所以废旧锂离子电池拆解前进行“放电处理”有利于Li+向正极移动并进入正极材料;提高浸取率的措施有固体粉碎、玻璃棒搅拌、适当升高浸取液的温度和增大浸取液的浓度等,故答案为:放电有利于Li+向正极移动并进入正极材料;粉碎、适当增大NaOH溶液的浓度(或适当升高温度等);
(3)①因Co3O4有较强氧化性,能氧化溶液里的Cl-,生成的氯气对环境有污染,发生反应的离子方程式为Co3O4+2Cl-+8H+=3Co2++Cl2↑+4H2O,故答案为:有Cl2生成,污染空气;
②根据表中不同浸出剂“酸溶”实验结果可知,使用HCl或H2SO4+Na2S2O3时浸出液化学成分中Co的含量高、钴浸出率也较高,Co3O4有较强氧化性,在酸性条件下氧化S2O32-生成SO42-,但Co3O4也能氧化Cl-,生成有污染性的氯气,不符合绿色化学理念,所以综合考虑应选择的浸出剂是H2SO4+Na2S2O3,即(c),故答案为:(c);Co3O4能氧化Cl-,生成有污染性的氯气,而Na2S2O3在溶液中受热影响小,因此选择(c)效果优于前者;
③Co3O4~Co2+~2e-,H2O2~O2~2e-,Na2S2O3~2Na2SO4~4e-,若还原1molCo3O4,则转移电子2mol,被氧化的H2O2的物质的量为1mol、被氧化的Na2S2O3的物质的量为0.5mol,所以还原等物质的量的Co3O4,需要Na2S2O3的物质的量更少,故答案为:Na2S2O3;
④综上考虑,最合适的浸出剂为H2SO4+Na2S2O3,根据电子守恒和原子守恒配平、写出的反应的化学方程式4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;
(4)若滤液2中含Co2+为5.9×10-2gL-1,c(Co2+)=![]() L1=10-3mol/L,且Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,则恰好转化为Co(OH)2时溶液中c(OH-)=
L1=10-3mol/L,且Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,则恰好转化为Co(OH)2时溶液中c(OH-)=![]() mol/L=10-6mol/L,c(H+)=10-8mol/L,此时溶液pH=8.0,即“沉碳酸钴“应控制pH不高于8.0,故答案为:8.0。
mol/L=10-6mol/L,c(H+)=10-8mol/L,此时溶液pH=8.0,即“沉碳酸钴“应控制pH不高于8.0,故答案为:8.0。


科目:高中化学 来源: 题型:
【题目】实验室用图所示装置制备KClO溶液,并通过KClO溶液与![]() 溶液的反应制备高效水处理剂
溶液的反应制备高效水处理剂![]() 已知
已知![]() 具有下列性质
具有下列性质![]() 可溶于水、微溶于浓KOH溶液,
可溶于水、微溶于浓KOH溶液,![]() 在
在![]() 、强碱性溶液中比较稳定,
、强碱性溶液中比较稳定,![]() 在
在![]() 和
和![]() 催化作用下发生分解,
催化作用下发生分解,![]() 在酸性至弱碱性条件下,能与水反应生成
在酸性至弱碱性条件下,能与水反应生成![]() 和
和![]() 。
。
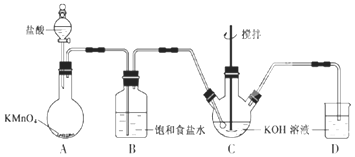
(1)装置A中![]() 与盐酸反应生成
与盐酸反应生成![]() 和
和![]() ,其化学方程式为______,装置B的作用是______。
,其化学方程式为______,装置B的作用是______。
(2)![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,试写出该反应的离子方程式______。
,试写出该反应的离子方程式______。
(3)制备![]() 时,KClO饱和溶液与
时,KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
(4)已知![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 下表列出了几种离子生成氢氧化物沉淀的
下表列出了几种离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
开始沉淀的pH | 沉淀完全的pH | |
|
|
|
|
|
|
|
|
|
实验中可选用的试剂:![]() 、
、![]() 、
、![]() 由某硫酸锌溶液
由某硫酸锌溶液![]() 含
含![]() 、
、![]() 杂质
杂质![]() 制备ZnO的实验步骤依次为:
制备ZnO的实验步骤依次为:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用一氧化氮与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①NO2能与Na2O2反应;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
Ⅰ.制备亚硝酸钠

(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____________________________。
(2)上述装置按气流方向连接的顺序为:a→____________________(填仪器接口的字母编号)。
(3)D中反应的方程式为_____________________________。如果没有B装置,D中生成的亚硝酸钠中含有的杂质有______________(填化学式)。
(4)C装置的作用是_________________(用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量4.000 g产品配成250 mL溶液。
②从步骤①配制的溶液中移取25.00 mL加入锥形瓶中。
③用0.1000 mol/L酸性KMnO4溶液滴定至终点。
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00 mL。
(5)达到滴定终点的现象是____________。产品中NaNO2的纯度为______________%。
(6)设计实验证明HNO2的酸性比CH3COOH强_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知![]() ,则
,则![]() 的燃烧热为
的燃烧热为![]()
B.已知甲烷氧化:![]() ,则反应物的键能总和大于生成物的键能总和
,则反应物的键能总和大于生成物的键能总和
C.已知![]() ,则将
,则将![]() 和
和![]() 置于一密闭容器中充分反应后放出
置于一密闭容器中充分反应后放出![]() 的热量
的热量
D.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则该反应的热化学方程式为:
的热量,则该反应的热化学方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe3H2O,Mr=288)是常用的补铁剂。乳酸亚铁可由乳酸与FeCO3反应制得。
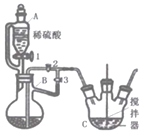
Ⅰ.制备碳酸亚铁(FeCO3)
(1)仪器B的名称是______。
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第-步骤的目的是:______。
②C中反应生成白色沉淀的离子方程式是:______。
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀,检验其是否洗净的方法是______(填操作,现象和结论)。
④从产品纯度角度指出该实验装置中存在的缺陷______。
Ⅱ.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。请设计实验检测产品在制备过程是否因氧化而发生变质(填操作,现象和结论):______。
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀盐酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴______作指示剂,用0.10mol/L的硫代硫酸钠溶液滴定(I2+2S2O32-=S4O62-+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
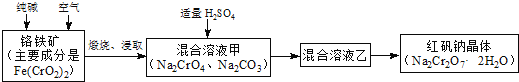
(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成 ______ .
可写成 ______ .
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是 ______
为了加快该反应的反应速率,可采取的措施是 ______ ![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是 ______ .
②混合溶液乙中溶质的化学式是 ______ .
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______ ,若继续加水稀释,平衡将 ______ 移动
______ ,若继续加水稀释,平衡将 ______ 移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:![]() --
--![]() ._________
._________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.20gD2O含有的中子数为10NA
B.1L0.1mo1L-1亚硫酸钠溶液含有的SO32-数目为0.1NA
C.1molKMnO4被还原为Mn2+转移的电子数为5NA
D.16gO2和32gO3的混合物中所含原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为___,该元素的符号是___;
(2)Y元素原子的价层电子的电子排布图为___,该元素的名称是___;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110℃失去结晶水,230℃分解。某化学研究小组对K3[Fe(C2O4)3]3H2O受热分解生成的气体产物和固体产物进行探究。
实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。

(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为__。
(2)装置的连接顺序为:A→__→__→__→__→__→F(填各装置的字母代号)。__
(3)检查装置气密性后,先通一段时间N2,其目的是__,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是__。
(4)实验过程中观察到F中的溶液变浑浊,C中有红色固体生成,则气体产物__(填化学式)。
实验二:分解产物中固体成分的探究
(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。
定量实验:将固体产物加水溶解、过滤洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的___(填仪器编号)。

设计下列三种实验方案分别对该含铁样品进行含量的测定
甲方案:ag样品![]() 溶液
溶液![]() 得固体bg
得固体bg
乙方案:ag样品![]() 测得气体体积VmL(标况)
测得气体体积VmL(标况)
丙方案:ag样品![]() 250mL溶液
250mL溶液![]() 三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
你认为以上方案中可以确定样品组成的有__方案。
(6)经测定产物中n(FeO):n(Fe)=1:1,写出K3[Fe(C2O4)3]3H2O分解的化学方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com