
【题目】(6分)煤等化石燃料燃烧时产生的SO2 会对大气造成污染。如果某火力发电厂每秒燃烧10kg煤,煤中硫元素的质量分数为1%。假设煤中的硫全部转化为SO2,试计算该发电厂每天产生SO2的物质的量。
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O (莫尔盐,浅绿色)是重要的化工原料和化学试剂。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
(1)甲组同学猜想:莫尔盐的分解产物可能是N2、Fe2O3、SO3和H2O四种物质。你是否同意甲组同学的猜想,并说明理由:______________________。
(2)乙组同学按照如下图所示的装置进行实验,关闭止水夹,加热A中的莫尔盐固体至分解完全,检验其分解产物。
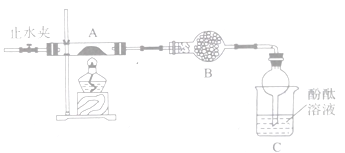
①装置B的仪器名称是______________,所盛试剂是_________________。
②装置C中可观察到的现象是________________, 由此可知硫酸亚铁铵分解的产物中有___________。
(3)丙组同学选用乙组实验中的装置A和下图所示的装置,进行实验验证莫尔盐分解的产物中还有SO2和SO3。
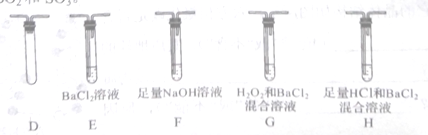
①丙组同学的实验装置中,依次连接的合理顺序为A______________(用装置字母表示)。取适量固体于A中,通入 N2一段时间后,关闭止水夹,冉点燃酒精灯。通入N2的目的是___________________ 。
②若装置H中有白色沉淀生成,则证明分解产物中有__________________;能证明分解产物中有SO2的实验现象是___________________ 。
(4)丁组同学将一定量的莫尔盐在500℃的隔绝空气加热—段时间后,检验其固体产物。设计实验证明,此固体产物不含二价铁:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较中,正确的是
①沸点:H2O>HCl>HF ②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4④离子半径:O2->F->Na+
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况可能引起大气污染的是( )
①煤的燃烧 ②工业废气任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A. 只有①② B. 只有②④ C. 只有①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 溴水中有平衡:Br2+H2O![]() HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+ NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
C. 升高温度能够增大硝酸钾在水中的溶解度
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
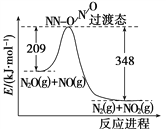
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500 ℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
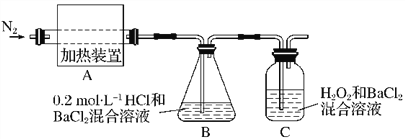
① A中固体充分加热较长时间后,通入氮气,目的是__________________________。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________(填字母)。
A.KSCN溶液 B.稀硫酸
C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________气体生成,若含有该气体,观察到的现象为_______________________________________。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________(填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________(用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO![]() +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com