
| 化合物 | 相对分子质量 | 密度/g?cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

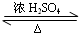 CH3COOCH2CH2CH2CH3+H2O,
CH3COOCH2CH2CH2CH3+H2O,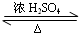 CH3COOCH2CH2CH2CH3+H2O;
CH3COOCH2CH2CH2CH3+H2O;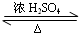 CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O | 15.1g |
| 23.2g |


科目:高中化学 来源: 题型:
| 化合物 | 相对分子质量 | 密度/g?cm-3 | 水溶性 | 沸点/℃ |
| 甲酸 | 46 | 1.22 | 与水混溶 | 100.8 |
| 甲醇 | 32 | 0.79 | 与水混溶 | 64.7 |
| 甲酸甲酯 | 60 | 0.98 | 与水不互溶 | 32.0 |
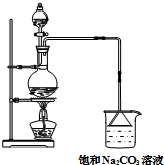 同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:
同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、它们分别与足量CaCO3反应时,放出的CO2一样多 |
| D、分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
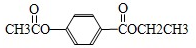
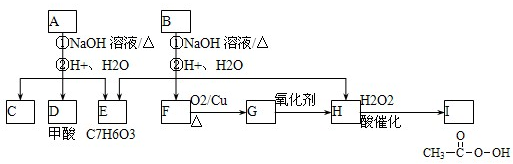
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g甲基(-14CH3)所含的中子数为8NA |
| B、64g的铜发生氧化还原反应,一定失去2 NA个电子 |
| C、常温常压22.4LNO气体的分子数为NA |
| D、标况时,22.4L三氯甲烷所含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
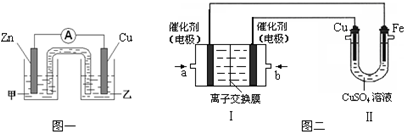
查看答案和解析>>
科目:高中化学 来源: 题型:
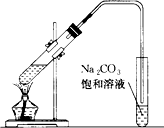 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com