
【题目】下列氧化还原反应所标出的电子转移情况中没有错误的是( )
A.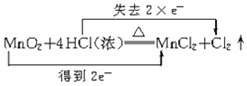 +2H2O
+2H2O
B.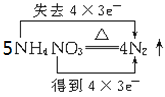 +2HNO3+9H2O
+2HNO3+9H2O
C.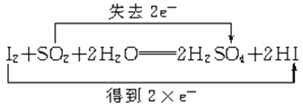
D.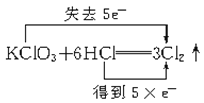 +3H2O+KCl
+3H2O+KCl
科目:高中化学 来源: 题型:
【题目】已知氟化氢气体中有平衡系:
①2H3F3(g)=3H2F2(g ) ΔH1=akJ·mol-1 ②H2F2 (g)=2HF(g) ΔH2=bkJ·mol-1 已知a、b均大于0,则可推测反应:H3F3(g)=3HF(g)的ΔH3等于( )
A. (a+b) kJ·mol-1B. (a-b) kJ·mol-1
C. (a+3b) kJ·mol-1D. (0.5a+1.5b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的化学方程式正确的是
A. FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B. 90℃时,测得纯水中c(H+)·c(OH-)=3.8 ×10-13:H2O(l)![]() H+(aq)+OH-(aq)△H<0
H+(aq)+OH-(aq)△H<0
C. 氨水中滴入酚酞溶液.溶液变红:NH3·H2O=NH4++OH-
D. 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某反应体系中存在六种粒子:ClO4-、SO42-、ClO3-、S2O82-、H+、H2O。在反应过程中,溶液的 pH 与反应进程的关系如图所示。下列说法正确的是

A. ClO4-是氧化剂
B. SO42-是氧化产物
C. 氧化性:S2O82->ClO3-
D. 生成 1 mol 还原产物时转移 2 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示,下列说法不正确的是( )

A.转化NO2过程的化学方程式为:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
B.转化器工作过程中,当转移0.6mol电子时,会消耗4.48LNH3
C.尿素水溶液热分解反应不属于氧化还原反应
D.该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,难溶于冷水,易溶于酸。其制备装置及步骤如下:
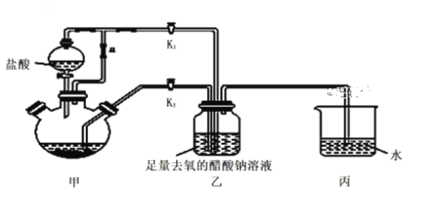
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
(1)三颈烧瓶中的Zn与盐酸生成H2的作用____________,还发生的另一个反应的离子方程式为______________。
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为______________,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________、洗涤、干燥。
(3)装置丙中导管口水封的目的是______________。
(4)若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是__________________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____________________。
(4)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入________g FeSO4·7H2O。
(5)FeSO4·7H2O晶体制备步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50 ℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
①反应时铁屑过量的目的是(用离子方程式表示) ________________________。
②溶液趁热过滤的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com