
| A.铁制农具生锈 |
| B.铝导线与铜导线相连接易腐蚀 |
| C.手机锂电池充电 |
| D.纯银饰品在空气中逐渐变暗 |
科目:高中化学 来源:不详 题型:单选题
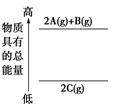
| A.①③⑥ | B.②④⑤ |
| C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 | B.NaNO3 | C.Mg(NO3)2 | D.Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
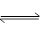 2SO3”为可逆反应,请回答:
2SO3”为可逆反应,请回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
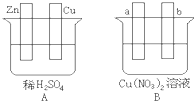
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
| 装置 | 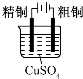 | 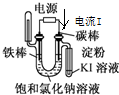 | 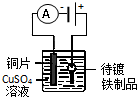 | 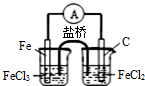 |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B.某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂 |
| C.因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D.理论上说,任何能自发进行的氧化还原反应都可被设计成原电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
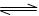 2NH3 (g) △H<0。下列分析正确的是 ( )
2NH3 (g) △H<0。下列分析正确的是 ( )| A.平衡后加入N2,该反应的△H增大 |
| B.若平衡昏升高温度,则平衡常数K变大 |
| C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大 |
| D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com