
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】食品干燥剂在食品加工、储存中应用非常广泛。食品干燥剂应无毒、无味、无腐蚀性及对环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥
C.六水氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
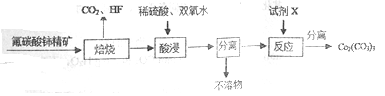
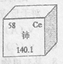
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物 ②不能跟酸反应的氧化物一定能跟碱反应 ③碱性氧化物肯定是金属氧化物 ④分散系一定是混合物 ⑤浊液均可用过滤的方法分离
A.①③ B.③④ C.②④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
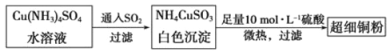
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
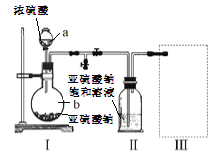
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
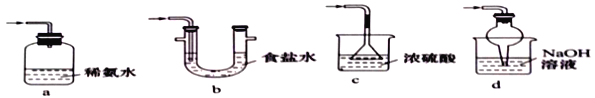
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com